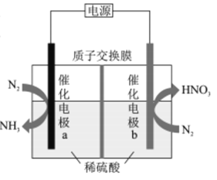
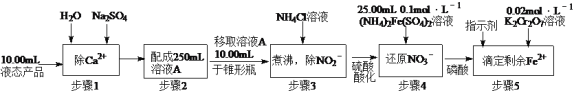
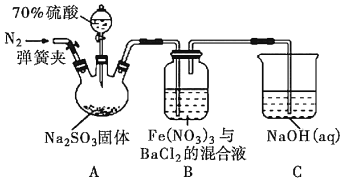
题目内容
【题目】已知在1×105Pa,常温条件下,2molH2燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(g) ΔH=-242kJ·mol-1
O2(g) ΔH=-242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) ΔH=+242kJ·mol-1
O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
【答案】D
【解析】
A项、2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收242kJ热量,热化学方程式为H2O(g)=H2(g)+![]() O2(g)ΔH=+242kJ·mol-1,故A不正确;
O2(g)ΔH=+242kJ·mol-1,故A不正确;
B项、生成的水应该为气态,而不是液态,故B错误;
C项、该反应为放热反应,ΔH应为—242kJ·mol-1,故C错误;
D项、在1×105Pa,常温条件下,2molH2燃烧生成水蒸气放出484kJ热量,则热化学方程式为2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1,故D正确;
故选D。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目