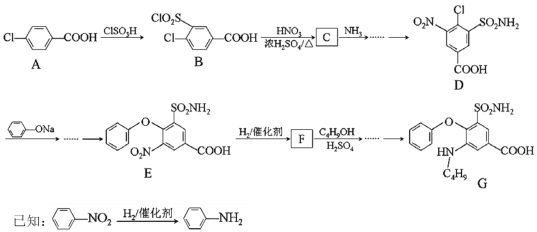
题目内容
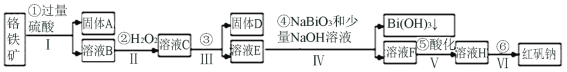
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为![]() 。
。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)Fe在元素周期表中的位置______________________________,反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的______________。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使![]() 转化为
转化为![]() ,写出该反应的离子方程式_________________。
,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
【答案】第四周期第ⅤⅢ族 增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率 NaOH溶液 Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀 3NaBiO3+2Cr3++7OH-+H2O=2CrO![]() +3Na++3Bi(OH)3 2CrO
+3Na++3Bi(OH)3 2CrO![]() +2H+Cr2O
+2H+Cr2O![]() +H2O 重结晶
+H2O 重结晶
【解析】
铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸浸取,固体A为不溶于酸的SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入过氧化氢将Fe2+氧化生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液E主要含有Cr3+,在溶液E中加入NaBiO3和NaOH,发生氧化还原反应生成Bi(OH)3,同时Cr3+被氧化为CrO![]() ,所以溶液F主要含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O72H2O,以此解答该题。
,所以溶液F主要含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O72H2O,以此解答该题。
(1)Fe为26号元素,核外电子排布式为[Ar]3d64s2,位于第四周期第ⅤⅢ族;将矿石粉碎,可增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率;
(2)步骤③加入的试剂是为了调节pH使Al3+、Fe3+转化为沉淀,从而除去,为了不引入新的杂质,该试剂可以为NaOH溶液;根据表格数据可知pH调到5时Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀;
(3)在溶液E中加入NaBiO3和NaOH,根据题目信息可知发生氧化还原反应,Cr3+被氧化为CrO![]() ,根据流程可知Bi元素转化为Bi(OH)3,结合得失电子守恒和元素守恒可得反应的离子方程式为3NaBiO3+2Cr3++7OH-+H2O=2CrO
,根据流程可知Bi元素转化为Bi(OH)3,结合得失电子守恒和元素守恒可得反应的离子方程式为3NaBiO3+2Cr3++7OH-+H2O=2CrO![]() +3Na++3Bi(OH)3;
+3Na++3Bi(OH)3;
(4)酸化使CrO42-转化为Cr2O72-,反应的离子方程式为2CrO![]() +2H+Cr2O
+2H+Cr2O![]() +H2O;
+H2O;
(5)通过重结晶的方法可以进一步提纯粗晶体,得到精制红矾钠。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是( )
A | B | C | D | |
实验目的 | 制备氢氧化铁胶体 | 分离乙酸乙酯和饱和Na2CO3溶液 | 除去CO2中的少量HCl | 收集NO2 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D