题目内容
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
分析 A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值;
B.NA个氧原子的质量就是1mol该原子质量;
C.氧原子的质子数为8,1个氧原子所含的电子数是8个;
D.氧原子的中子数不一定为8.
解答 解:A.元素是指具有相同核电荷数(核内质子数)的一类原子的总称.一种元素因中子数不同,有多种原子.元素的相对原子质量是指该元素的同位素按其丰度计算的平均值.氧原子的相对原子质量为$\frac{12a}{b}$,但该值也不是氧元素的相对原子质量,故A错误;
B.氧原子的质量为ag,1mol氧原子含NA个氧原子,故NA个氧原子的质量为aNAg,故B正确;
C.一个该氧原子的质量是a,xg该氧原子个数为x/a.1个氧原子所含的电子数是8个,则xg该氧原子所含的电子数为$\frac{8x}{a}$,故C错误;
D.氧原子有多种,中子数不一定是8,故中子数不一定为$\frac{8y}{a}$,故D错误.
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.有关图示装置的叙述不正确的是( )
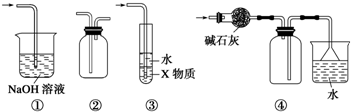

| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
7.观察电子处于1s轨道的电子云图,判断下列说法正确的是( )


| A. | 一个小黑点表示1个自由运动的电子 | |
| B. | 1s轨道的电子云形状为圆形的面 | |
| C. | 电子在1s轨道上运动像地球围绕太阳旋转 | |
| D. | 1s轨道电子云图中小黑点的疏密表示电子在某一位置出现机会的多少 |
14.下列叙述错误的是( )
| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 | |
| C. | 配位键在形成时,是由成键双方各提供一个电子形成共用电子 | |
| D. | 三种不同的非金属元素可以形成离子化合物 |
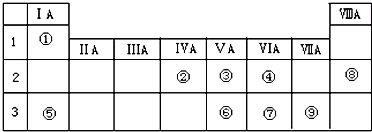
11.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)金属性最强的元素是钙(填元素名称);
(2)a原子结构示意图为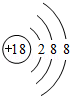 ;
;
(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
(2)a原子结构示意图为
 ;
;(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |

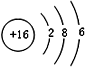 ;
; .
.