题目内容
9.A、B、D、E、F为中学化学常见的化合物.A、B、D、E的焰色反应为黄色,F为无色无味的气体.相互转化关系如下:A+F→B+O2;B+F+H2O→D;D+E→B+H2O.请根据题目要求回答下列问题:
(1)A+F→B+O2的化学方程式2Na2O2+2CO2=2Na2CO3+O2,D溶液与E溶液反应的离子方程式HCO3-+OH-=CO32-+H2O.
(2)如图装置(Ⅰ)为以E为电解质的氢氧燃料电池的示意图.装置(Ⅰ)中G和N为气体进口,其中G口进入的是(填名称)氢气,写出电极②发生反应的电极反应式_O2+2H2O+4e-=4OH-
(3)装置(Ⅱ)是最新研制的装有涂二氧化钛光电板的光电解水装置的示意图,在电极③K出口产生的是(填化学式)O2.
分析 A、B、D、E、F为中学化学常见的化合物,A、B、D、E的焰色反应为黄色,则A、B、D、E中都含有钠元素,F为无色无味的气体,根据A+F→B+O2,可知A为Na2O2,F为CO2,B为Na2CO3,根据B+F+H2O→D可知,D为NaHCO3,根据D+E→B+H2O可知,E为NaOH,据此答题.
解答 解:A、B、D、E、F为中学化学常见的化合物,A、B、D、E的焰色反应为黄色,则A、B、D、E中都含有钠元素,F为无色无味的气体,根据A+F→B+O2,可知A为Na2O2,F为CO2,B为Na2CO3,根据B+F+H2O→D可知,D为NaHCO3,根据D+E→B+H2O可知,E为NaOH,
(1)A+F→B+O2的化学方程式为 2Na2O2+2CO2=2Na2CO3+O2,D溶液与E溶液反应的离子方程式为HCO3-+OH-=CO32-+H2O,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;HCO3-+OH-=CO32-+H2O;
(2)E为NaOH,以E为电解质的氢氧燃料电池中,氢气是还原剂,在负极发生氧化反应,有电子流出,氧气是氧化剂,在正极发生还原反应,有电子流进,G口进入的是氢气,电极②发生反应的电极反应式为,
故答案为:氢气;O2+2H2O+4e-=4OH-;
(3)在电解池中电流方向与电子方向相反,从阳极流向阴极,所以电极③为阳极,电极④为阴极,在阳极上水发生氧化反应生成氧气,所以在电极③K出口产生的是O2,
故答案为:O2.
点评 本题考查无机物推断,焰色反应、转化关系中部分产物等是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
20.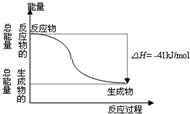 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
17.(Ⅰ)观察图A、B、C,回答下列问题:
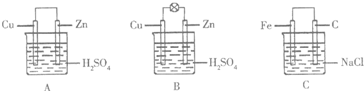
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是温度升高H2O2的分解速率加快,导致H2O2的浓度降低从而使铜的溶解速率慢.

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
4.下列实验操作正确的是( )
| A. | 实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
14.表中实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 向苯酚溶液中滴加稀溴水 | 观察白色沉淀三溴苯酚 |
| B | 向待测液中加入碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3ml5%CuSO4溶液中滴加3-4滴2%氢氧化钠溶液,再向其中加入0.5ml乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
 .
.