题目内容
9.下表列出了①--⑨九种元素在周期表中的位置: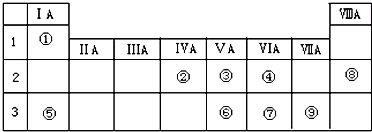
请按要求回答下列问题.
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期ⅥA,从元素原子得失电子的角度看,元素④具有氧化性性(填氧化性、还原性);
(2)按气态氢化物的稳定性由弱到强的顺序排列⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式);
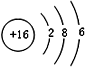
(3)元素⑦的原子结构示意图是
 ;
;(4)写出元素⑤形成的单质在氧气中燃烧的化学反应方程式2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,这一反应是放热(填吸热、放热)反应;
(5)用电子式表示①与⑨反应得到的化合物的形成过程
 .
.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)元素④的名称是氧,根据元素在周期表中所处周期数、主族数确定元素④在周期表中所处位置,原子最外层电子数大于4的元素在反应中易得电子,体现氧化性;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(4)元素⑤形成的单质是Na,钠在氧气中燃烧生成过氧化钠,所有的燃烧反应都是放热反应;
(5)①和⑨两元素组成的化合物是HCl,为共价化合物.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)元素④的名称是氧,元素④在周期表中所处位置为第二周期第VIA族,原子最外层电子数大于4的元素在反应中易得电子,所以氧气体现氧化性,
故答案为:氧; 第二周期ⅥA; 氧化性;
(2)元素的非金属性越强,其氢化物的稳定性越强,元素非金属性P<S<O,所以氢化物的稳定性PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(3)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)元素⑤形成的单质是Na,钠在氧气中燃烧生成过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,所有的燃烧反应都是放热反应,所以该反应是放热反应,故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;放热;
(5)①和⑨两元素组成的化合物是HCl,为共价化合物,用电子式表示其形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表和元素周期律的综合应用,需要学生熟练掌握元素周期表结构及元素符号,注意理解掌握用电子式表示物质或化学键的形成,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
| A. | CH3Br | B. | 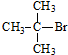 | C. | (CH3)3CCH2Br | D. | 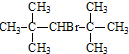 |
| A. | 蚕丝、羊毛、病毒等主要成分都是蛋白质 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水,也不溶解 | |
| C. | 重金属盐能使蛋白质凝结 | |
| D. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应 |
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
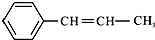 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不溶于水,易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为: | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.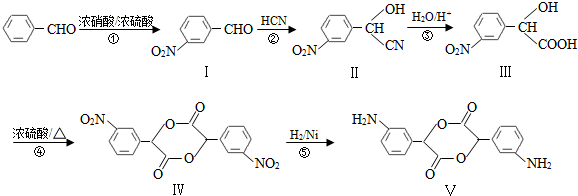
 ,和
,和 .
.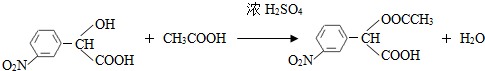 (要求写出反应条件),
(要求写出反应条件),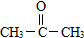 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为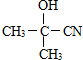 .
.