题目内容
14.下列叙述错误的是( )| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 | |
| C. | 配位键在形成时,是由成键双方各提供一个电子形成共用电子 | |
| D. | 三种不同的非金属元素可以形成离子化合物 |
分析 A.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,而共价键有方向性和饱和性;
B.金属晶体是由金属阳离子和自由电子构成的;
C.含有空轨道和含有孤电子对的原子之间易形成配位键;
D.非金属元素间可以形成离子键.
解答 解:A.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故A正确;
B.金属晶体是由金属阳离子和自由电子构成的,金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用,相互作用包含吸引力和排斥力,故B正确;
C.配位键在形成时,含有孤电子对的原子提供电子、含有空轨道的原子提供轨道,二者形成配位键,故C错误;
D.非金属元素间可以形成离子键,如氯化铵是由铵根离子和氯离子形成的离子键,含有三种元素,故D正确;
故选C.
点评 本题考查了化学键的有关知识,明确离子键、共价键及金属键特点即可解答,注意化学键中的关键词“相互作用”的含义,知道配位键属于共价键而不是单独的一种化学键,为易错点.

练习册系列答案
相关题目
4.下列实验操作正确的是( )
| A. | 实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
5.下列正确的是( )
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
2.下列说法正确的是( )
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
9.L电子层最多可容纳的电子数为( )
| A. | 3个 | B. | 8个 | C. | 9个 | D. | 18个 |
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
6.指出下列化合物中化学键的类型、物质分类(离子化合物、共价化合物)以及溶于水时破坏的化学键的类型.
| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | |||
| HCl | |||
| (NH4)2SO4 |
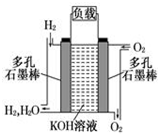 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回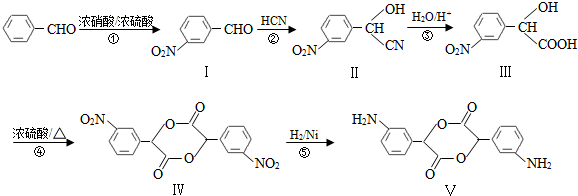
 ,和
,和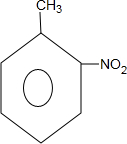 .
.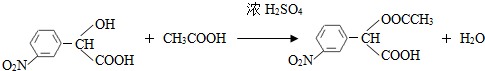 (要求写出反应条件),
(要求写出反应条件),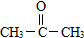 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为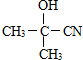 .
.