题目内容
4.下列5种物质:A.CO2 B.NH3 C.SO2 D.H2SO4 E.NaCl其中,能使品红溶液腿色的是C(填字母,下同),属于电解质的是DE,遇氯化氢有白烟生成的是B,与氯化钡溶液反应产生白色沉淀的是D.分析 具有漂白性的物质可使品红褪色;在水溶液中或熔化状态下能导电的化合物为电解质;易挥发且与HCl反应生成白色固体的物质,现象为冒白烟;含硫酸根离子的物质与氯化钡溶液反应产生白色沉淀.
解答 解:具有漂白性的物质可使品红褪色,5种物质只有C能使品红溶液褪色;在水溶液中或熔化状态下能导电的化合物为电解质,则只有D、E为电解质,A、B、C本身不能电离,为非电解质;易挥发且与HCl反应生成白色固体的物质,现象为冒白烟,只有B符合;含硫酸根离子的物质与氯化钡溶液反应产生白色沉淀,只有D符合,
故答案为:C;DE;B;D.
点评 本题考查较综合,涉及常见元素化合物的性质,把握物质的结构与性质、物质的特性、反应与现象的关系及离子检验、电解质的判断等为解答的关键,注重基础知识的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
14.表中实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 向苯酚溶液中滴加稀溴水 | 观察白色沉淀三溴苯酚 |
| B | 向待测液中加入碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3ml5%CuSO4溶液中滴加3-4滴2%氢氧化钠溶液,再向其中加入0.5ml乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键一定是有s轨道参与形成的 | |
| C. | 甲烷分子中的键全为σ键而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键而Cl2分子中还含π键 |
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
9.按常温常压下沸点升高的次序,排列正确的是:( )
①正丁烷 ②壬烷 ③异丁烷 ④三十烷.
①正丁烷 ②壬烷 ③异丁烷 ④三十烷.
| A. | ②③①④ | B. | ③①②④ | C. | ①③②④ | D. | 无法确定 |
16.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 氧化钠是强电解质,醋酸是弱电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
13.某小组要探究卤族元素的非金属性强弱,设计了如下实验,请按要求填空.
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象 溶液分层下层为紫红色 | 写出试管①中的离子方程式: Cl2+2Br-=2Cl-+Br2 |
| 2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式: Br2+2I-=2Br-+I2 |
| 实验结论: 元素非金属性由强到弱的顺序为:Cl>Br>I. | ||
14.下列物质能发生消去反应的是( )
| A. | CH3Br | B. | 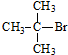 | C. | (CH3)3CCH2Br | D. | 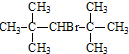 |
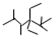 的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,
的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,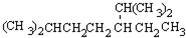 的名称为2,6-二甲基-3-乙基庚烷.
的名称为2,6-二甲基-3-乙基庚烷. ,
,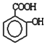 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式: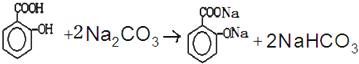 ,
,