题目内容
11.1,2-二溴乙烷可做汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).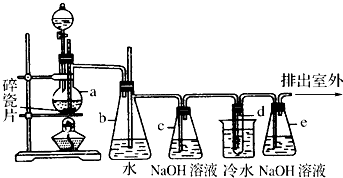
(1)写出试管d中发生反应的化学反应方程式CH2=CH2+Br2→CH2BrCH2Br.
(2)b装置的作用是安全瓶,防止倒吸,b装置也可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象锥形瓶内液面下降,玻璃管中的水面会上升,甚至溢出.
(3)容器c中NaOH溶液的作用是:除去乙烯中带出的酸性气体(或二氧化碳、二氧化硫).
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因①乙烯产生(或通过液溴)速度过快,
②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以).
分析 在加热170℃、浓硫酸作催化剂条件下,乙醇发生消去反应生成乙烯;b为安全瓶,可以防止倒吸,也可以检查实验进行时试管d是否发生堵塞;乙醇可能被浓硫酸氧化生成二氧化碳,同时生成二氧化硫,则NaOH吸收酸性氧化物,从而得到较纯净的乙烯;乙烯和溴发生加成反应生成1,2-二溴乙烷,根据1,2-二溴乙烷熔点,d的目的是得到1,2-二溴乙烷,溴具有挥发性,所以从d中出来的气体中含有溴蒸气,会污染大气,用e中NaOH吸收溴蒸气,
(1)乙烯和溴发生加成反应生成1,2-二溴乙烷;
(2)b为安全瓶,能防止倒吸,也能检验装置是否堵塞;
(3)氢氧化钠溶液能吸收酸性氧化物;
(4)根据乙烯与溴反应的利用率减少的可能原因进行解答.
解答 解:在加热170℃、浓硫酸作催化剂条件下,乙醇发生消去反应生成乙烯;b为安全瓶,可以防止倒吸,也可以检查实验进行时试管d是否发生堵塞;乙醇可能被浓硫酸氧化生成二氧化碳,同时生成二氧化硫,则NaOH吸收酸性氧化物,从而得到较纯净的乙烯;乙烯和溴发生加成反应生成1,2-二溴乙烷,根据1,2-二溴乙烷熔点,d的目的是得到1,2-二溴乙烷,溴具有挥发性,所以从d中出来的气体中含有溴蒸气,会污染大气,用e中NaOH吸收溴蒸气,
(1)乙烯和溴发生加成反应生成1,2-二溴乙烷,反应方程式为CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)b为安全瓶,能防止倒吸,也能检验装置是否堵塞,发生堵塞时瓶b中的现象为锥形瓶内液面下降,玻璃管中的水面会上升,甚至溢出,
故答案为:安全瓶、防止倒吸;锥形瓶内液面下降,玻璃管中的水面会上升,甚至溢出;
(3)乙醇和浓硫酸发生氧化还原反应生成二氧化硫和二氧化碳,氢氧化钠溶液能吸收酸性氧化物二氧化碳、二氧化硫,所以该装置的作用是除去乙烯中带出的酸性气体(或二氧化碳、二氧化硫),
故答案为:除去乙烯中带出的酸性气体(或二氧化碳、二氧化硫);
(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应,此外,实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可),会导致副反应的发生和副产物的生成,
故答案为:①乙烯发生(或通过液溴)速度过快;②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可).
点评 本题考查制备实验方案设计,为高频考点,明确物质性质及实验原理是解本题关键,知道可能发生的反应、各个装置的作用,难点是(4)题分析,同时考查学生思维的缜密性、实验操作能力,题目难度中等.

(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
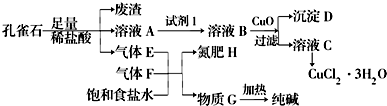
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
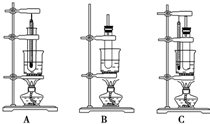 现有三种实验装置,如图,要制备硝基苯,应选用( )
现有三种实验装置,如图,要制备硝基苯,应选用( )| A. | 装置A | B. | 装置B | C. | 装置C | D. | 都不行 |
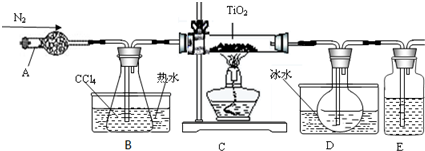
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
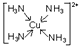 .已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.