题目内容
6. 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).试回答:
(1)烧杯内发生反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O;
(2)向盛有饱和氯水的烧杯中加入碳酸钙,会产生碳酸钙溶解,有气泡冒出现象;
(3)本方法可提高次氯酸的浓度的理由氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡正向移动;
(4)取加入碳酸钙后烧杯中清液,进行如下实验:
①该清液滴在有色布条上有极强的漂白作用;
②该清液中滴加碳酸钠溶液产生白色沉淀;
③该清液中滴加盐酸可产生大量气体;
④该清液加热后变浑浊并产生大量气体.
现通过上述实验,写出氯水和碳酸钙反应的化学方程式为2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO;
(5)已知:K1(H2CO3)>Ka(HClO)>K2(H2CO3),向NaClO溶液中通入少量CO2的化学方程式为:CO2+NaClO+H2O=NaHCO3+HClO.
分析 (1)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(2)氯水中含有盐酸,盐酸能够与碳酸钙反应;
(3)氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡移动;
(4)依据反应产物中有HClO、Ca(HCO3)2、CaCl2,书写化学方程式;
(5)因为K1(H2CO3)>Ka(HClO)>K2(H2CO3),所以少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3;
解答 解:(1)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)氯水中含有盐酸,向盛有饱和氯水的烧杯中加入碳酸钙,盐酸能够与碳酸钙反应生成氯化钙和二氧化碳、水,现象为:固体碳酸钙溶解,有气泡冒出;
故答案为:碳酸钙溶解,有气泡冒出;
(3)氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡正向移动,提高氯水中HClO的浓度;
故答案为:氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡正向移动;
(4)根据实验(1)-(4)实验步骤发生的反应和物质判断可知氯水和碳酸钙反应的化学方程式为2CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO,
故答案为:2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO;
(5)Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3,化学方程式:CO2+NaClO+H2O=NaHCO3+HClO,
故答案为:CO2+NaClO+H2O=NaHCO3+HClO;
点评 本题通过氯气的制备考查了氯气、次氯酸的性质,涉及离子方程式书写、化学方程式的书写、化学平衡移动的影响因素,明确弱酸电离平衡常数与酸的强度是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
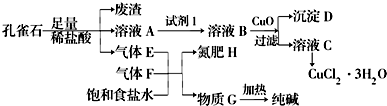
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
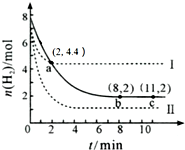
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
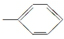 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.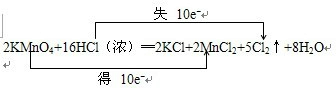 .
.