题目内容
8.下表数据是对应物质的熔点,下列说法错误的是( )| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
分析 离子晶体熔沸点较高,分子晶体熔沸点较低,根据晶体熔沸点知,氟化铝属于离子晶体,氯化铝、氯化硼、氯化氮属于分子晶体,
A.如果中心原子最外层电子数+共价键个数=8时该分子中所有原子都满足8电子稳定结构;
B.NCl3中心原子价层电子对数为4对,而BCl3中心原子价层电子对数为3对;
C.氯化铝是分子晶体,氟化铝属于离子晶体;
D.不同非金属元素之间易形成共价键,分子中正负电荷重心重合的分子为非极性分子.
解答 解:离子晶体熔沸点较高,分子晶体熔沸点较低,根据晶体熔沸点知,氟化铝属于离子晶体,氯化铝、氯化硼、氯化氮属于分子晶体,
A.BCl3中B原子最外层电子数+共价键个数=3+3=6,所以该分子中所有原子不达到8电子稳定结构,NCl3中N原子最外层电子数+共价键个数=5+3=8,所以该分子中各原子最外层都满足8电子稳定结构,故A错误;
B.NCl3中心原子价层电子对数为4对,而BCl3中心原子价层电子对数为3对,所以NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多,故B正确;
C.AlF3、AlCl3在水溶液里都完全电离,属于强电解质,氯化铝属于分子晶体,氟化铝属于离子晶体,所以晶体类型不同,故C正确;
D.该分子中B和Cl原子之间形成极性键,BCl3为平面正三角形分子,正负电荷重心重合,为非极性分子,故D正确;
故选A.
点评 本题考查晶体类型与熔沸点的关系,涉及化学键的判断、分子极性的判断、8电子结构、晶体类型的判断等知识点,侧重考查基本理论,知道8电子稳定结构的判断方法,注意氯化铝属于分子晶体而不是离子晶体,为易错点.

练习册系列答案
相关题目
19.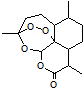 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 每个分子中含有4个六元环 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
3.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 绚丽缤纷的烟花与原子核外电子发生跃迁吸收能量有关 | |
| C. | 叶绿素、血红素和维生素B12都是配合物 | |
| D. | 当单一波长的X-射线通过石英玻璃时,在记录仪上可看到分立的斑点或谱线 |
17.有关苯的结构和性质,下列说法正确的是( )
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
6.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图所示.
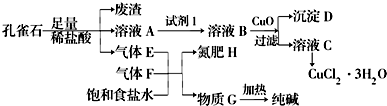
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
(1)E、H的化学式依次为CO2、NH4Cl.
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
 .
. ,属于离子 化合物(填“离子”或“共价”).
,属于离子 化合物(填“离子”或“共价”). ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.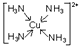 .已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.