题目内容
15.环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境.某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮.有关物质信息、实验流程及实验装置如下:环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃).
主反应:
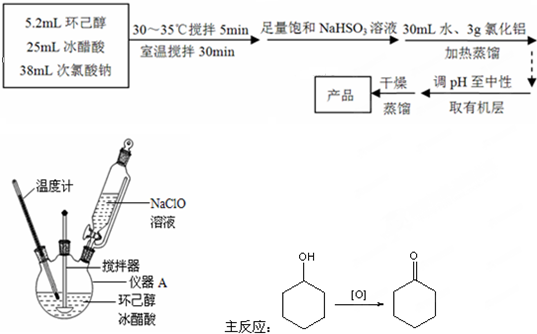
(1)回答下列问题:仪器A的名称是三颈烧瓶.
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有搅拌器搅拌、缓慢滴加NaClO溶液.
(3)加入足量的饱和NaHSO3溶液时发生主要反应是ClO-+HSO3-═Cl-+H++SO42-(用离子方程式表示).
(4)①在实验流程两次蒸馏中都用到沸石防暴沸,下列关于沸石的说法正确的是AD.
A.实验室沸石也可用碎瓷片等代替
B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用
D.沸石为多孔性物质,可使液体平稳地沸腾
②为将馏出液的pH调至中性,可以加入的试剂是BD.
A.稀盐酸 B.无水碳酸钠 C.浓硫酸 D.氢氧化钠固体
(5)调节pH后还需加入精制食盐,其目的是降低环己酮的溶解度,有利于环己酮分层,“取有机层”时使用的主要仪器是分液漏斗.
分析 本题是探究运用次氯酸钠氧化环己醇制备环己酮的实验流程,解题时要关注环己酮的物理性质,涉及制备与分离提纯,其中反应在三颈烧瓶中进行,此反应是放热反应,可通过冰水浴及控制反应物的用量等措施来控制温度,反应后的混合物分离时先用饱和NaHSO3溶液除去过量的次氯酸钠,再通过连续二次蒸馏对混合物进行分离提纯,得到较纯净的目标产物;
(1)根据实验装置图及常见的仪器分析;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,利用饱和NaHSO3溶液可除去过量的次氯酸钠;
(4)①液体混合物加热时通常加沸石防暴沸,如果忘记一定要待反应液冷却后再添加;
②分馏得到的液体显酸性,调整到中性,应添加碱性溶液;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶,或借鉴盐析的原理进行分离.
解答 解:(1)由实验装置图可知,图2中仪器A的名称是三颈烧瓶,故答案为:三颈烧瓶;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,同时通过控制反应物的用量,来控制反应速率,因此要缓慢滴加NaClO溶液,故答案为:搅拌器搅拌;缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-,故答案为:ClO-+HSO3-═Cl-+H++SO42-;
(4)①A.实验室可用碎瓷片等代替沸石,正确;
B.如果忘加沸石,应停止加热,待冷却后再添加,错误;
C.当重新进行蒸馏时,用过的沸石不可继续使用,否则会引入杂质,错误;
D.沸石能防暴沸是因为为多孔性物质,可使液体平稳地沸腾,正确;
故答案为:AD;
②无水碳酸钠的溶液和氢氧化钠溶液都显碱性,可中和酸性溶液到中性,故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,静置后会分层,可用分液漏斗分离,所以选择的仪器为分液漏斗,故答案为:降低环己酮的溶解度,有利于环己酮分层;分液漏斗.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.

| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
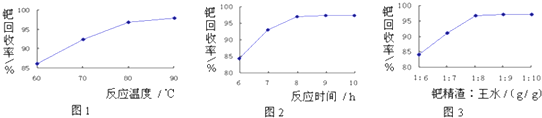
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
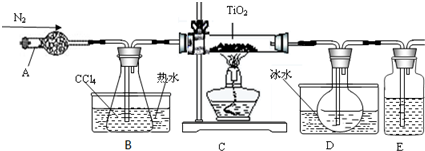
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.
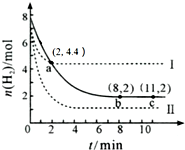
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$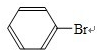 +HBr
+HBr