题目内容
4.碳的多样性体现在碳单质的多样性、含碳化合物的多样性、碳及其化合物应用的多样性等方面.
(1)乙烯分子中σ键与π键的数目之比为5:1.
(2)掺杂铬的石墨镀层是一种高硬度的自动润滑剂,基态铬原子的电子排布式为1s22s22p63s23p63d54s1.
(3)石墨烯(如图1)是目前科技研究的热点,可看作将石墨的层状结构一层一层地剥开得到的单层碳原子层晶体.理论上12g石墨烯中有$\frac{1}{2}$NA个六元碳环.
(4)碳化硅(SiC)俗名“金刚砂”,有类似金刚石的结构和性质,其空间结构中碳硅原子相间排列,如图2所示(其中●为碳原子,○为硅原子).
①第一电离能大小比较:C>Si(填“>”、“<”或“=”).
②碳化硅晶体中,C-Si键的键角都是109°28′.
③若设该晶胞的边长为apm,则碳化硅晶体的密度是$\frac{160}{(a×1{0}^{-10})^{3}{N}_{A}}$g•cm-3(只要求列算式,不必计算出数值.阿伏伽德罗常数的数值为NA).
分析 (1)乙烯中单键为σ键,双键中一个是σ键、一个是π键;
(2)Cr是24号元素,其原子核外有24个电子,根据构造原理书写基态Cr原子核外电子排布式;
(3)石墨烯中平均每个环上C原子个数=1×$\frac{1}{3}$×6=2,12g石墨中物质的量=$\frac{12g}{12g/mol}$=1mol,碳原子个数为NA;
(4)①同一主族元素,元素第一电离能随着原子序数增大而减小;
②碳化硅中每个C原子和四个Si原子形成正四面体结构,其键角和甲烷键角相同;
③该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,根据ρ=$\frac{m}{V}$计算其密度
解答 解:(1)乙烯中单键为σ键,双键中一个是σ键、一个是π键,所以乙烯分子中σ键与π键的数目之比=5:1,
故答案为:5:1;
(2)Cr是24号元素,其原子核外有24个电子,根据构造原理知基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(3)石墨烯中平均每个环上C原子个数=1×$\frac{1}{3}$×6=2,12g石墨中物质的量=$\frac{12g}{12g/mol}$=1mol,碳原子个数为NA,所以六元环个数为$\frac{1}{2}$NA,
故答案为:$\frac{1}{2}$NA;
(4)立体网状结构的晶体为原子晶体,二氧化碳晶体中每个C原子连接4个O原子,价层电子对个数是4,所以C原子采用sp3杂化,故答案为:原子晶体;sp3;
(5)①同一主族元素,元素第一电离能随着原子序数增大而减小,所以第一电离能C>Si,故答案为:>;
②碳化硅中每个C原子和四个Si原子形成正四面体结构,其键角和甲烷键角相同,所以其键角是,故答案为:109°28′;
③该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=$\frac{m}{V}$=$\frac{\frac{40×4}{{N}_{A}}}{(a×10{\;}^{-10}){\;}^{3}}$g•cm3=$\frac{160}{(a×1{0}^{-10})^{3}{N}_{A}}$g•cm3,
故答案为:$\frac{160}{(a×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化判断、原子核外电子排布式的书写等知识点,这些都是高考高频点,知道构造原理、价层电子对互斥理论内涵,难点是晶胞计算,题目难度中等.

| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
| A. | 氯乙烷中加入硝酸银溶液:Cl-+Ag+═AgCl↓ | |
| B. | 溴乙烷与氢氧化钠水溶液共热:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| C. | 丙烯聚合:nCH2═CHCH3$→_{△}^{催化剂}$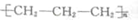 | |
| D. | 苯酚钠溶液中通入少量二氧化碳: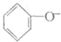 +CO2+H2O→ +CO2+H2O→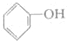 +HCO3- +HCO3- |
| A. | S(g)+O2(g)═SO2(g)△H=a;S(s)+O2(g)═SO2(g)△H=b;则a>b | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定石墨比金刚石稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,则该反应任何温度下都能自发进行 |
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键 | |
| C. | 邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确 | |
| D. | 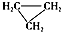 和CH3-CH═CH2互为同分异构体 和CH3-CH═CH2互为同分异构体 |
| A. | 青苹果汁只含淀粉 | B. | 熟苹果汁中只含有葡萄糖 | ||
| C. | 苹果转熟时葡萄糖聚合为淀粉 | D. | 苹果转熟时淀粉水解为葡萄糖 |