题目内容
19.三氟化铵(NF3)是为电子工业中优良的等离子蚀刻气体,它在潮湿的环境中能发生反应:3NF3+5H2O═2NO+HNO3+9HF,下列有关说法正确的是( )| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
分析 3NF3+5H2O═2NO+HNO3+9HF中,N元素的化合价由+3价降低为+2价,由+3价升高为+5价,摩尔质量的单位为g/mol,以此来解答.
解答 解:A.NF3的摩尔质量为71g/mol,故A错误;
B.NF3→HNO3是被氧化的过程,NF3为还原剂;2NF3→2NO是被还原的过程,NF3是氧化剂,所以还原剂与氧化剂的物质的量之比为1:2,故B错误;
C.生成1 mol HNO3转移2 mol电子,所以生成0.2 mol HNO3转移0.4 mol电子,故C错误;
D.NF3与潮湿的空气中的水反应生成NO,NO与空气中的O2反应生成红棕色的NO2,故D正确;
故选D.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答的关键,注意电子守恒的应用,题目难度中等

练习册系列答案
相关题目
8.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐.A$\stackrel{X}{→}$B$\stackrel{Cl_{2}}{→}$C$\stackrel{O_{2}}{→}$D$\stackrel{O_{2}}{→}$E$\stackrel{H_{2}O}{→}$F.
下列说法中不正确的是( )
下列说法中不正确的是( )
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
10.(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
写出该反应的热化学方程式CH3-CH3(g)→CH2=CH2(g)+H2(g)△H=+125.6 kJ•mol-1
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
7.一定温度时,向2.0L恒容密闭容器中充入1.omolPCl5,发生反应:
PCl5(g)?PCl3(g)+Cl2(g)
经一段时间后反应达到平衡,反应过程中测得的部分数据见下表:
下列说法正确的是( )
PCl5(g)?PCl3(g)+Cl2(g)
经一段时间后反应达到平衡,反应过程中测得的部分数据见下表:
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(PCl5)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol•L-1,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0molPCl5和0.20 molCl2,在反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0molPCl5和1.0 molCl2,在反应达到平衡时PCl5的转化率为80% |
11.在一定条件下,下列药物的主要成分都能发生①取代反应 ②加成反应 ③水解反应 ④中和反应四种反应的是( )
| A. | 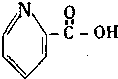 维生素 | B. | 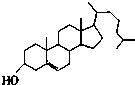 胆固醇 | ||
| C. | 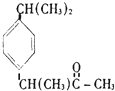 芬必得 | D. | 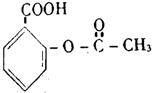 阿斯匹林 |
9.在由Fe3O4和 Fe组成的6.88g固体混合物中加入稀硫酸,当加入50mL 2mol/LH2SO4时,恰好使固体完全溶解,并放出一定量气体.在所得溶液中加入KSCN溶液,溶液不变红色.则下列说法正确的是( )
| A. | 混合物中Fe的物质的量为0.03mol | |
| B. | 混合物中Fe3O4的物质的量为0.01mol | |
| C. | 反应中产生的气体在标准状况下的体积为448mL | |
| D. | 若用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到7.2g铁 |
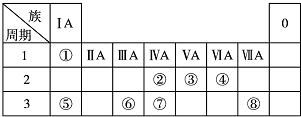
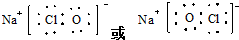 .
.
