题目内容
15.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
分析 常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;
B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;
C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;
D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;
E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
根据以上分析进行解答.
解答 解:常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
(1)E为Fe元素,其基态核外电子排布式为:1s22s22p63s23p63d64s2,铁元素位于第4周期第VIII族,基态原子未成对电子为3d轨道的4个电子,
故答案为:第4周期第VIII族;4;
(2)B、C、D分别为C、N、Cl元素,非金属性越强,电负性越强,则电负性大小为:Cl>N>C,
故答案为:Cl>N>C;
(3)C单质为N2,N2分子含氮氮三键,δ键和π键的个数比为1:2;由于氨分子间存在氢键,故使其沸点出现反常,
故答案为:1:2;NH3分子间易形成氢键;
(4)D的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,共热能发生反应,生成一种气体单质,应为Cl2,反应的方程式为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O;
(5)由A、B两种元素组成的含4个原子的非极性分子为乙炔,乙炔的电子式为 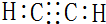 ;
;
已知乙炔的燃烧热为1200kJ∕mol,则乙燃烧热的热化学反应方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol,故答案为: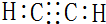 ;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol;
;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol;
(6)已知N2(g)+3H2(g)?2NH3(g)△H=-akJ/mol,其表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
恒温恒容下,2molNH3完全转化到左边,可得3molH2和1molN2,故与原平衡为等效平衡,平衡时NH3的浓度相同,令平衡时氮气的物质的量为ymol,向容器中充入1molN2和3molH2,平衡时参加反应的氮气为(1-y)mol,根据N2(g)+3H2(g)?2NH3(g);△H=-akJ/mol,可知放出的热量为(1-y)mol×akJ/mol=a(1-y)kJ,即a(1-y)=b,
向容器中充入2molNH3,到达平衡时,生成氮气ymol,根据N2(g)+3H2(g)?2NH3(g);△H=-akJ/mol,可知吸收的热量为ymol×akJ/mol=aykJ,即c=ay,所以a=b+c,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;a=b+c.
点评 本题考查结构性质位置关系应用,题目难度中等,涉及电负性、电离能、方程式的书写、化学平衡的计算等知识,注意掌握原子结构与元素周期表、元素周期律的关系,(6)为易错点,注意等效平衡原理的应用.

| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
| A. | 该反应中氢气做还原剂,铝做氧化剂 | |
| B. | 在空气中Al2O3比 B2H6更稳定 | |
| C. | B2H6中存在极性键、非极性键、离子键 | |
| D. | 每生成1mol B2H6要消耗2molAlCl3 |
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素的原子结构示意图为
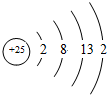 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
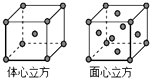
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
| A. | 丙烷与甲烷互为同系物 | |
| B. | 通常条件下,丙烷性质稳定,不与酸、碱和氧化剂发生反应 | |
| C. | 丙烷燃烧是吸热反应 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
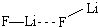 .
.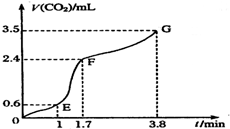 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: