题目内容
5.元素周期表是学习化学的工具,也为化学的进一步探索与研究提供了理论指导,化学学习者和研究者一直关注周期表的运用与发展.试回答下列问题:(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是H(填写元素符号).
(2)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是Xe(填写元素符号).
(3)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为61.
(4)人们研究发现第一周期与第二周期一些元素的性质与同族元素性质共性很少,有人建议将氢放在VIIA,写出一种能支持该观点的化合物:NaH;人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式:
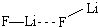 .
.(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如硼与硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:2B+2OH-+2H2O═2BO2-+3H2↑.
分析 (1)首先产生了中子、质子和电子数最少的元素;
(2)首先被用来与F2反应制备稀有气体化合物的元素的性质最活泼;
(3)质子数+中子数=质量数;
(4)把氢放在ⅦA族,说明氢与ⅦA族元素有某些相似性质,在ⅦA族元素能与活泼金属形成离子化合物如NaCl等;由氢键迁移书写锂键;
(5)B、Si性质相似,都能与NaOH反应,但二者化合价不同,可进一步联系Al与NaOH反应书写.
解答 解:(1)首先产生了中子、质子和电子,H元素只含有一个质子和一个电子,所以最先产生的元素为H;
故答案为:H;
(2)因首先被用来与F2反应制备稀有气体化合物的元素的性质最活泼,而稀有气体化学性质相对稳定,从上至下,稀有气体元素金属性增强,相对来说易失去电子,所以最先制得Xe的氟化物,
故答案为:Xe;
(3)118号元素的质子数为118,其原子的质量数为297,则中子数=297-118=179,则中子数与质子数之差为179-118=61;
故答案为:61;
(4)把氢放在ⅦA族,说明氢与ⅦA族元素有某些相似性质,在ⅦA族元素能与活泼金属形成离子化合物化合物如NaCl等,而氢也能形成NaH等,二者相似,可以支持题中观点;由氢键迁移到锂键,可得(LiF)2含锂键的结构式: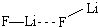 ,
,
故答案为:NaH;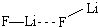 ;
;
(5)B、Si性质相似,都能与NaOH反应,但二者化合价不同,结合Al与NaOH反应可知,B与氢氧化钠溶液反应离子方程式为:2B+2OH-+2H2O═2BO2-+3H2↑,
故答案为:2B+2OH-+2H2O═2BO2-+3H2↑.
点评 本题考查了原子结构、以及通过由硅到硼的性质和由氢键到锂键的拓展,考查了学生的知识迁移能力与创新能力,题目难度中等.

练习册系列答案
相关题目
2.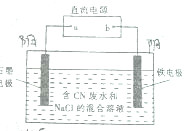 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
20.佳味备醇存在于槟榔子叶中,其结构如右: 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )
 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )| A. | 佳味备醇含有一个苯环,它是一种芳香族化合物 | |
| B. | 佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应 | |
| C. | 佳味备醇分子中至少有十二个原子在同一平面上 | |
| D. | 1mol佳味备醇分别与氢气、溴水反应时,最多消耗4molH2,4molBr2 |
10.如图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )


| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
14.甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量≥99.8%.为检验得到的乙酸中是否含有甲醇,可用的方法是( )
| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
15.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是,其基态原子未成对电子有4个.
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形. ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5. (1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形. 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.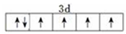 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.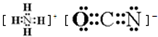 .
.