题目内容
4. 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:(1)写出发生反应的离子方程式CaCO3+2H+=Ca2++H2O+CO2↑;
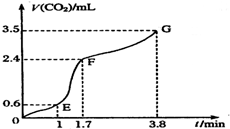
(2)实验过程中绘制出生成CO2的体积[V(CO2)]与时间(t)的关系如图所示,试分析判断OE段、EF段、
FG段反应速率(分别用v(OE)、v(EF)、v(FG)表示)哪个最快υ(EF);比较OE段和EF段,说明EF段速率变化的主要原因可能是温度较高、浓度较大.
分析 (1)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;
(2)斜率越大,说明单位时间生成的二氧化碳越多,则反应速率越大;
解答 解:(1)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)E→F段曲线的斜率较大,说明单位时间生成的二氧化碳最多,则反应速率最大,因此阶段浓度较大,且反应放热,温度较高,反应速率最大,随着反应的进行,浓度逐渐降低,则反应速率逐渐减小,
故答案为:υ(EF);温度较高、浓度较大;
点评 本题考查化学反应速率的影响因素,注意把握图象斜率的判断以及反应速率大小比较的角度,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
14.甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量≥99.8%.为检验得到的乙酸中是否含有甲醇,可用的方法是( )
| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
15.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是,其基态原子未成对电子有4个.
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4△_△––––––KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+5252O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=c2(NH3)c(N2)•c3(H2)(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)B、C、D的电负性由大到小的顺序是Cl>N>C(用元素符号表示).
(3)C单质分子中δ键和π键的个数比是,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4△_△––––––KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的分子,乙的电子式是.已知乙的燃烧热为1200kJ∕mol,乙燃烧热的热化学反应方程式是C2H2(g)+5252O2(g)=2CO2(g)+H2O(l);△H=-1200kJ/mol.
(6)在一定温度下,向一个容积不变的密闭容器中充入1molC2和3molA2,发生反应:Y2(g)+3A2(g)?2YA3(g)△H=-akJ/mol.在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=c2(NH3)c(N2)•c3(H2)(用化学式表示).若起始向此容器中充入2molAH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为a=b+c(用一个式子表示).
12.下列各组混合物,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2的质量不变的是( )
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
19.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Na+、CO32-、Cl- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | K+、H+、SO42-、OH- | D. | Ag+、Al3+、NO3-、H+ |
16.铀是自然界中能够找到的最重元素.地球上存量最多的是92238U,关于92238U下列说法正确的是( )
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |

 +H2O.
+H2O.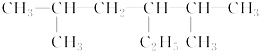 的名称是2,5-二甲基-3-乙基己烷
的名称是2,5-二甲基-3-乙基己烷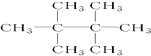 名称是2,2,3,3-四甲基丁烷.
名称是2,2,3,3-四甲基丁烷.