题目内容
2.8g Fe全部溶于一定浓度200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液中c(H+ )=0.1mol?L-1.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A、反应后溶液中存在Fe3+和Fe2+ |
| B、1.12L气体是NO、NO2的混合气体 |
| C、反应后溶液中c(NO3-)=0.85mol?L-1 |
| D、反应后的溶液最多还能溶解1.4g Fe |
考点:氧化还原反应的计算,化学方程式的有关计算
专题:计算题
分析:测得反应后溶液的c(H+ )=0.1mol?L-1,则硝酸剩余,Fe失去电子变为Fe3+,n(Fe)=
=0.05mol,n(气体)=
=0.05mol,则由电子守恒可知,生成气体为NO,反应后的溶液中硝酸与硝酸铁中含NO3-,结合3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算最多消耗的Fe,以此来解答.
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
解答:
解:A.因硝酸剩余,Fe完全反应,发生Fe失去电子变为Fe3+,则反应后溶液中铁元素一定只以Fe3+形式存在,故A错误;
B.n(Fe)=
=0.05mol,n(气体)=
=0.05mol,则由电子守恒可知,气体中N元素的化合价为+2价,则气体为NO,故B错误;
C.反应后的溶液中硝酸与硝酸铁中含NO3-,c(NO3-)=
=0.85 mol/L,故C正确;
D.原硝酸为0.02mol+0.05mol+0.15mol=0.22mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.22mol×
×56=4.62g,则还能溶解4.62g-2.8=1.82g,故D错误;
故选C.
B.n(Fe)=
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
C.反应后的溶液中硝酸与硝酸铁中含NO3-,c(NO3-)=
| 0.2L×0.1mol/L+0.05mol×3 |
| 0.2L |
D.原硝酸为0.02mol+0.05mol+0.15mol=0.22mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.22mol×
| 3 |
| 8 |
故选C.
点评:本题考查氧化还原反应的计算,明确硝酸剩余发生的化学反应及最多溶解铁发生的化学反应是解答本题的关键,注意利用电子守恒来分析生成的气体,选项D为解答的难点,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
分析下面的能量变化图,判断下列选项中正确的是( )
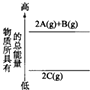

| A、2A(g)+B(g)═2C(g)△H>0 |
| B、2A(g)+B(g)═2C(g)△H<0 |
| C、2A+B═2C△H<0 |
| D、2C═2A+B△H<0 |
下列说法中正确的是( )
| A、所有主族元素的正化合价数,等于它的族序数 |
| B、第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C、第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D、前三周期元素中共有非金属元素12种 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、常温下,
| ||
| B、加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- | ||
| C、加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2- | ||
| D、由水电离产生的c(H+)=1×10-12的溶液:NH4+、Na+、AlO2-、HCO3- |
现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是( )
| A、加热挥发HCl |
| B、加水使平衡向正反应方向移动 |
| C、加NaOH中和HCl |
| D、加CaCO3中和HCl |
能证明SO2具有漂白性的实验是( )
| A、SO2使酸性KMnO4溶液褪色 |
| B、SO2使溴水褪色 |
| C、SO2使品红溶液褪色 |
| D、SO2使含酚酞的NaOH溶液褪色 |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
| B、12g金刚石中含有的共价键键数为4NA |
| C、0.1mol NaHCO3晶体中含0.2NA个离子 |
| D、1mol甲基(-CH3)所含电子数为9NA |
下列叙述与对应图式正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 主要化合价 | -2 | +2 | +1 | +5、-3 | +7、-1 | +1 | +5、-3 | +3 |
| A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强 |
B、 如图装置中,待镀铁制品应与电源负极相连 |
C、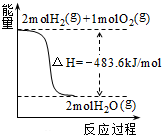 如图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol |
D、 如图表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |