题目内容
若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
(1)试比较K1、K2的大小,K1 K2(填“<”“>”或“=”);
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为 .当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”).
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:(1)对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
(2)化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(2)化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向;
解答:
解:(1)该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K=
=2;
容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:6mol/L、4mol/L、2mol/L,400℃时,浓度商Qc=
=
<K=2,说明反应正向进行,因此有v(N2)正>v(N2)逆;
故答案为:2;>;
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K=
| 1 |
| 0.5 |
容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:6mol/L、4mol/L、2mol/L,400℃时,浓度商Qc=
| 4×23 |
| 62 |
| 8 |
| 9 |
故答案为:2;>;
点评:本题考查化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.

练习册系列答案
相关题目
下列说法正确的是( )
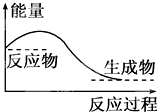

| A、任何化学反应都伴随着能量的变化 |
| B、H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 |
| C、化学反应中能量的变化都表现为热量的变化 |
| D、对于如图所示的过程,是吸收能量的过程 |
将乙炔通入苯和甲醛形成混合溶液,测得此混合溶液中碳的质量分数为a,则该混合物中氧的质量分数为( )
A、1-
| ||||
B、1-
| ||||
C、
| ||||
D、
|
2.8g Fe全部溶于一定浓度200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液中c(H+ )=0.1mol?L-1.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A、反应后溶液中存在Fe3+和Fe2+ |
| B、1.12L气体是NO、NO2的混合气体 |
| C、反应后溶液中c(NO3-)=0.85mol?L-1 |
| D、反应后的溶液最多还能溶解1.4g Fe |
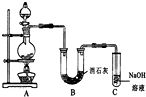 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).