题目内容
6.下列关于氯水的说法正确的是( )| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
分析 A.二氧化硫通入氯水发生氧化还原反应生成盐酸和硫酸;
B.氯水中加入NaCl固体,氯离子浓度增大,Cl2+H2O?HCl+HClO逆向移动;
C.pH=2的氯水,c(H+)=0.01mol/L,结合电荷守恒分析;
D.次氯酸的酸性弱于碳酸,向氯水中滴加少量的NaHCO3溶液,生成氯化钠、次氯酸和二氧化碳.
解答 解:A.二氧化硫具有还原性,氯水中通入二氧化硫气体时,发生反应SO2+Cl2+2H2O═H2SO4+2HCl,减弱了氯水的漂白性,故A错误;
B.氯水中加入NaCl固体,氯离子浓度增大,Cl2+H2O?HCl+HClO逆向移动,氢离子浓度减小,pH增大,故B错误;
C.pH=2的氯水,c(H+)=0.01mol/L,由电荷守恒可知,c(H+)=c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L,故C正确;
D.氯水中滴加少量NaHCO3溶液,盐酸与其反应生成NaCl、水、二氧化碳,发生的离子反应为Cl2+H2O?H++Cl-+HClO、H++HCO3-═CO2↑+H2O,故D错误;
故选:C.
点评 本题考查了氯气的化学性质,为高频考点,综合考查元素化合物性质,熟悉氯水的成分及氯气、次氯酸性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.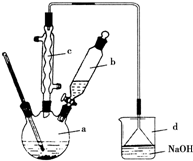 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
(1)实验装置中,仪器c的名称为球形冷凝管,作用为冷凝、回流.
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3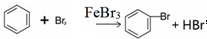 .
.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.
 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:| 苯 | 溴 | 溴苯 | |
| 密度/g.cm3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3
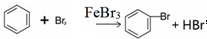 .
.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.
14.已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在一个30mL大试管中注入4mL乙醇,再分别缓缓加入4mL乙酸、1mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀;
写出制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(3)步骤②中需要小火均匀加热操作,其主要理由是:因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,温度过高可能发生其它副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:(答两点)
①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生
②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量,或增加了冷凝装置,有利于收集产物乙酸乙酯.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在一个30mL大试管中注入4mL乙醇,再分别缓缓加入4mL乙酸、1mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀;
写出制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(3)步骤②中需要小火均匀加热操作,其主要理由是:因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,温度过高可能发生其它副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:(答两点)
①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生
②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量,或增加了冷凝装置,有利于收集产物乙酸乙酯.
1.下列表达中不正确的是( )
| A. | 1molH2 | B. | 2 molNa2CO3 | C. | 0.5mol氧 | D. | 2 molOH- |
11.下列对相关概念的理解正确的是( )
| A. | 物质的量就是数量,只是描述对象为微观粒子 | |
| B. | 摩尔质量在数值上等于相对原子(或分子)质量,所以HCl的摩尔质量为36.5 | |
| C. | 阿伏伽德罗常数约为6.02×1023 | |
| D. | 物质的量是一个物理量,它将宏观的质量或体积与微观的粒子数联系起来 |
15.在一固定容积的密闭容器中,充入2mol CO2和1mol H2发生如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度降低(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是BC(填字母序号).
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )•c(H2)=c(CO)•c(H2O)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度降低(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是BC(填字母序号).
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )•c(H2)=c(CO)•c(H2O)
16.下列物质的水溶液中,呈酸性的是( )
| A. | CO2 | B. | NaOH | C. | NaHCO3 | D. | K2SO4 |
 一恒温恒容的容器由隔板分成A、B两室,隔板可自由滑动,两室温度始终保持20℃.A室内装有3mol H2和1mol O2的混合气体,此时挡板位置如图所示:请回答下列问题:
一恒温恒容的容器由隔板分成A、B两室,隔板可自由滑动,两室温度始终保持20℃.A室内装有3mol H2和1mol O2的混合气体,此时挡板位置如图所示:请回答下列问题: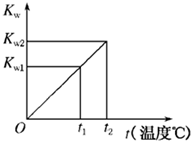 水的离子积常数Kw与温度t(℃)的关系如图所示:
水的离子积常数Kw与温度t(℃)的关系如图所示: