题目内容
18.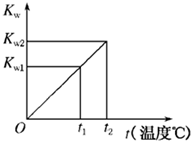 水的离子积常数Kw与温度t(℃)的关系如图所示:
水的离子积常数Kw与温度t(℃)的关系如图所示:(1)若t1=25℃,则Kw1=10-14;若t2=100℃时,Kw2=10-12,则此时
0.05mol•L-1的Ba (OH)2溶液的pH=11.
(2)已知常温下,0.1mol•L-1的H2A溶液的pH=3,请写出H2A在水中的电离方程式:H2A?HA-+H+,HA-?A2-+H+.
(3)已知25℃时,0.1L 0.1mol•L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:A-+H2O?HA+OH-,H2O?H++OH-.
溶液中各离子的物质的量浓度由大到小的顺序为:c(Na+)>c(A-)>c(OH-)>c(H+).
(4)100℃时,将pH=11的NaOH溶液与pH=2的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为1:9.
分析 (1)在25℃,则Kw=10-14,根据pH=-lgc(H+)计算pH;
(2)H2A为二元弱酸存在两步电离;
(3)根据0.1L 0.1mo/L的NaA溶液的pH=10判断盐的类型,确定存在的平衡,比较离子浓度的大小;
(3)设出氢氧化钠溶液为x和硫酸溶液的体积为y,根据题中数据列式计算出体积之比.
解答 解:(1)在25℃,则Kw=10-14,根据pH=-lgc(H+)=-lg$\frac{1{0}^{-12}}{0.1}$=11,
故答案为:10-14;11;
(2)已知常温下,0.1mol•L-1的H2A溶液的pH=3,则H2A为二元弱酸存在两步电离,其电离方程式为:H2A?HA-+H+,HA-?A2-+H+;
故答案为:H2A?HA-+H+,HA-?A2-+H+;
(3)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,属于强碱弱酸盐,存在平衡A-+H2O?HA+OH-,H2O?H++OH-,故不水解的钠离子浓度大于A-离子浓度,溶液显碱性,氢离子浓度大于氢氧根离子浓度,
故答案为:A-+H2O?HA+OH-,H2O?H++OH-;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10-3mol/L,pH=4的硫酸溶液中氢离子浓度为:10-4mol/L,
二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10-5mol/L,即氢氧化钠过量,即10-3mol/L×xL-10-4mol/L×y=10-5mol/L(x+y),
解得x:y=1:9,
故答案为:1:9.
点评 本题考查了水的电离平衡分析,离子积常数的计算应用,注意离子积是一定温度下的常数,随温度改变,掌握基础是关键,题目难度中等.

(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
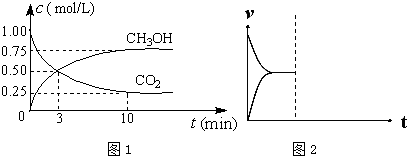
①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
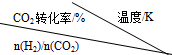 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
| A. | 在H2O2分解过程中,Fe2+是反应的催化剂 | |
| B. | 在H2O2生产过程中,要严格避免混入 Fe2+ | |
| C. | H2O2的氧化性比Fe3+强,还原性比Fe2+强 | |
| D. | 在H2O2分解过程中,溶液的pH逐渐下降 |
| A. | 碳元素的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
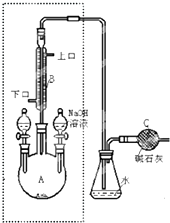 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.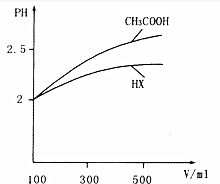 (1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
(1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)