题目内容
1.下列表达中不正确的是( )| A. | 1molH2 | B. | 2 molNa2CO3 | C. | 0.5mol氧 | D. | 2 molOH- |
分析 物质的量为基本物理量,其单位为mol,物质的量可以表示分子、原子、离子、质子、中子、电子等微粒,使用物质的量时必须指明具体的粒子名称,如1mol O2-、1mol O等,据此进行判断.
解答 解:A.1molH2表示1mol氢气分子,该表示方法合理,故A正确;
B.2 molNa2CO3表示2mol碳酸钠,指代明确,故B正确;
C.0.5mol氧,没有指明是0.5mol氧原子还是0.5mol氧气分子,该表示方法不规范,故C错误;
D.2 molOH-表示2mol氢氧根离子,该表示方法合理,故D正确.
故选C.
点评 本题考查了物质的量的使用方法,题目难度不大,试题侧重了基础知识的考查,注意明确物质的量的概念及表示方法,明确物质的量与摩尔之间的正确关系.

练习册系列答案
相关题目
3.铝和氢氧化钠溶液反应
化学方程式:①2Al+6HCl=2AlCl3+3H2↑,②2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 实验现象 | |
| 1.向打磨过的铝片中加入稀盐酸 | |
| 2.向打磨过的铝片中加入Na0H溶液 |
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
9.CO2可转化成有机物实现碳循环.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
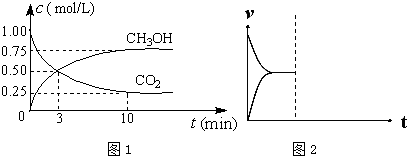
①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
分析表中数据回答下列问题:
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
16.质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数变为2a%,此时物质的量浓度为c2mol/L,则c1与c2的关系为( )
| A. | c2=2c1 | B. | c2<2c1 | C. | c2>2c1 | D. | c1=2c2 |
6.下列关于氯水的说法正确的是( )
| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
13.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法中,不正确的是( )
| A. | 在H2O2分解过程中,Fe2+是反应的催化剂 | |
| B. | 在H2O2生产过程中,要严格避免混入 Fe2+ | |
| C. | H2O2的氧化性比Fe3+强,还原性比Fe2+强 | |
| D. | 在H2O2分解过程中,溶液的pH逐渐下降 |

 恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.
恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.