题目内容
15.在一固定容积的密闭容器中,充入2mol CO2和1mol H2发生如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如表:| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度降低(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是BC(填字母序号).
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )•c(H2)=c(CO)•c(H2O)
分析 (1)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;
(2)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
再根据平衡常数K=1列方程计算解答;
(3)由表中数据可知,温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应.若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则平衡正向移动;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)CO2(g)+H2(g)?CO(g)+H2O(g)平衡常数表达式K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,
故答案为:$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
则$\frac{y×y}{(2-y)×(1-y)}$=1,解得y=$\frac{2}{3}$,故CO2气体的转化率为$\frac{\frac{2}{3}mol}{2mol}$×100%=33.3%,
故答案为:33.3%;
(3)由表中数据可知,温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应.若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则平衡正向移动,吸收热量,故容器内气体温度降低,
故答案为:降低;
(4)A.反应前后气体体积不变,容器内压强始终不变,故A错误;
B.混合气体中c(CO)不变,说明到达平衡,故B正确;
C.v正(H2)=v逆(H2O)说明氢气的生成速率与消耗速率相等,到达平衡状态,故C正确;
D.CO2与CO浓度与二氧化碳转化率有关,故D错误;
E.c(CO2 )•c(H2)=c(CO)•c(H2O)说明$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$=1,但温度影响平衡常数,不一定处于平衡状态,故E错误,
故选:BC.
点评 本题考查化学平衡计算、平衡常数、平衡状态判断等,注意化学平衡常数的表达式的书写与化学方程式中的计量系数有关,故其单位也不是唯一的,当反应中有固态或纯液态参与时,其浓度视为常数,不写在平衡常数关系式中;平衡常数只是温度的函数,只要温度一定,对于已经达到平衡的可逆反应,即是改变反应条件使平衡破坏,建立新平衡后,平衡常数K值也不变.

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
| A. | 碳元素的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
| A. | 常温下0.001 mol/L和0.10 mol/L 的HNO2溶液,分别用pH计测它们的pH,两者的pH相差小于2个单位 | |
| B. | 常温下90mL0.1 mol•L-1 HNO2溶液导电性比10mL0.1 mol•L-1 HCl溶液弱 | |
| C. | 10mL0.1 mol•L-1的HNO2与0.1 mol•L-1的NaOH恰好完全反应时,消耗10mLNaOH | |
| D. | 浓度相同的 HNO2溶液与NaNO2溶液中,后者NO2-浓度大 |
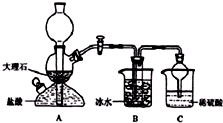 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:(1)A装置中所发生反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A装置B之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混有的HCl气体.
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体.请通过简单实验判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则
晶体不是NH4HCO3.
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为70%.
 .
.
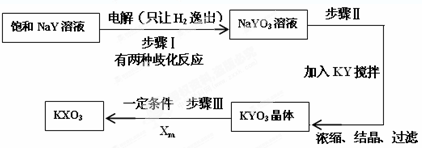
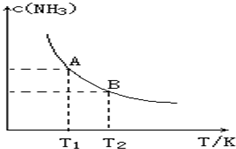 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.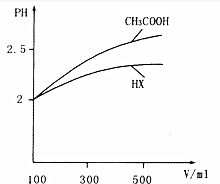 (1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
(1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)