题目内容
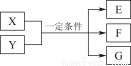
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置:
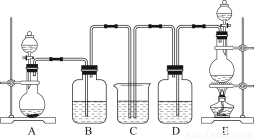
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验:
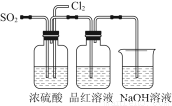
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。
(1)酸性、还原性
(2)恢复红色 仍无色
(3)吸收多余的SO2和Cl2,防止污染环境
(4)①使SO2和Cl2混合均匀,通过观察气泡控制气体的流速
②控制SO2和Cl2按物质的量之比1∶1进气,二者发生反应,生成无漂白性的H2SO4和HCl,离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+
③控制SO2和Cl2进气的物质的量,使之不相等
【解析】由题中装置图看出,装置A为制取SO2的实验装置,E为制取Cl2的实验装置,此实验装置可以验证SO2和Cl2的漂白性及其漂白特点。(1)装备E中发生的反应为4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑,浓盐酸表现出了酸性和还原性;(2)SO2和Cl2都具有漂白性,其中Cl2的漂白性是因为其强氧化性,是不可逆的,SO2的漂白性是与有色物质结合生成无色物质,是可逆的,加热时可以恢复原来的颜色,故B瓶的现象为恢复红色,D瓶无明显现象;(3)Cl2和SO2都能污染空气,所以实验产生的尾气要用NaOH溶液吸收;(4)Cl2和SO2可以发生反应:SO2+Cl2+2H2O=4H++2Cl-+SO42-,产物均无漂白性,所以当二者以物质的量之比为1∶1的比例通入时,品红溶液不褪色,当比例不为1∶1时,可以褪色但是褪色速率变慢;将气体先通过浓硫酸,可以根据气泡来控制气体的流速并且使气体混合均匀。
MnCl2+2H2O+Cl2↑,浓盐酸表现出了酸性和还原性;(2)SO2和Cl2都具有漂白性,其中Cl2的漂白性是因为其强氧化性,是不可逆的,SO2的漂白性是与有色物质结合生成无色物质,是可逆的,加热时可以恢复原来的颜色,故B瓶的现象为恢复红色,D瓶无明显现象;(3)Cl2和SO2都能污染空气,所以实验产生的尾气要用NaOH溶液吸收;(4)Cl2和SO2可以发生反应:SO2+Cl2+2H2O=4H++2Cl-+SO42-,产物均无漂白性,所以当二者以物质的量之比为1∶1的比例通入时,品红溶液不褪色,当比例不为1∶1时,可以褪色但是褪色速率变慢;将气体先通过浓硫酸,可以根据气泡来控制气体的流速并且使气体混合均匀。