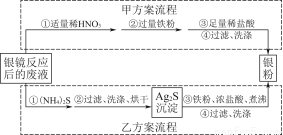
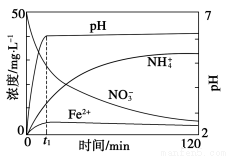
题目内容
已知X、Y在一定条件下发生反应,可以得到E、F、G。下列假设与结论能对应成立的是( )
选项假设结论
A若X、Y均为固体,E为气体则E一定能使湿润的蓝色石蕊试纸变红
B 若该反应是氯碱工业的主要反应,反应一段时间后两极产生的气体体积可能不同(不考虑气体的溶解)
C若X为单质,Y为氧化性酸,气体E是能引起酸雨的主要物质则Y一定是浓H2SO4
D若X为有机物,得到E是一种红色沉淀则X一定是醛
B
【解析】若X、Y分别为CuSO4和H2O,条件是电解,则气体E为O2,A项错误;电解NaCl溶液,当NaCl消耗尽时,其实质是电解水,阴阳极分别产生H2和O2,其体积比为2∶1,B项正确;若X为S,Y为浓硝酸,气体E也可为SO2,C项错误;甲酸的酯也有醛基,D项错误。

练习册系列答案
相关题目