题目内容
下列叙述正确的是( )
A.金属钠、钾在空气中易被氧化,应该在水中密封保存
B.某气体能使酸性KMnO4溶液褪色,该气体一定是SO2
C.Al(OH)3、NaHCO3和CaCO3均能用来治疗胃酸过多
D.为了延长钢闸门的使用寿命,可将其与电源正极相连
C
【解析】金属钠、钾应保存在煤油中,A项错误;凡具有较强还原性的气体均可使酸性高锰酸钾溶液褪色,如SO2、CH2=CH2等,B项错误;Al(OH)3、NaHCO3和CaCO3均可中和胃酸,能用来治疗胃酸过多,C项正确;为了延长钢闸门的使用寿命,可将其与电源负极相连,D项错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。
请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的
c(OH-)=________ mol·L-1。
(2)25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为__________,由水电离出的c(OH-)=__________ mol·L-1。
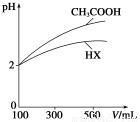
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是__________________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为____________________________。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________
(5)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。