题目内容
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
分析 同周期元素的原子半径随着核电荷数的增大而减小,第一电离呈增大的趋势,但同周期第ⅡA和第ⅤA族出现反常,同主族从上往下原子半径增大,第一电离能随着核电荷数的增大而减小,由此分析解答.
解答 解:A、同周期元素的原子半径随着核电荷数的增大而减小,故A错误;
B、同主族元素的原子半径随着核电荷数的增大而增大,故B正确;
C、同周期元素的第一电离能呈增大的趋势,但同周期第ⅡA和第ⅤA族出现反常,故C错误;
D、同主族元素的第一电离能随着核电荷数的增大而减小,故D错误;
故选B.
点评 本题考查结构性质位置关系、比较原子半径和电离能等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
4.由乙烯推测丙烯与溴水反应时,对反应产物的叙述正确的是( )
| A. | CH2Br-CH2-CH2Br | B. | CH3-CHBr-CH3 | C. | CH3-CH2-CHBr2 | D. | CH3-CHBr-CH2Br |
2.下列物质中属于共价化合物的是( )
| A. | Cl2 | B. | NH4Cl | C. | HCl | D. | NaOH |
9.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
19.能说明BF3分子中的4个原子处于同一平面的理由是( )
| A. | 3个B-F的键能相同 | B. | 3个B-F的键长相同 | ||
| C. | 3个B-F的键角均为120° | D. | 3个B-F的键均为σ键 |
6.同族元素所形成的同类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
3.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 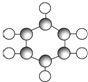 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).

 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: