题目内容
4.由乙烯推测丙烯与溴水反应时,对反应产物的叙述正确的是( )| A. | CH2Br-CH2-CH2Br | B. | CH3-CHBr-CH3 | C. | CH3-CH2-CHBr2 | D. | CH3-CHBr-CH2Br |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,根据乙烯与溴发生的加成产物推断丙烯和溴发生的加成反应.
解答 解:乙烯和溴发生加成反应时,碳碳双键断裂,每个碳原子上添加一个溴原子生成二溴乙烷,根据乙烯和溴的加成反应得,丙烯和溴的加成反应是丙烯中的碳碳双键断裂,每个双键的碳原子上添加一个溴原子,生成1,2-二溴丙烷,
故选D.
点评 本题考查了加成反应的原理,难度不大,注意加成反应的断键方式.

练习册系列答案
相关题目
9.K2Fe04是一种既能杀菌消毒,豕能聚凝净水的水处理剂,工业上制备该物质的反应为:Fe(OH)3+C1O-+OH-→FeO42-+Cl-+H20 (未配平),则下列有关说法正确的是( )
| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
15.核电荷数为1~18的元素中,下列叙述正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |
12.碳碳双键不能自由旋转,所以,R-CH=CH-R可能有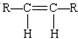 和
和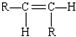 两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )
两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )
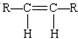 和
和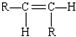 两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )
两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )| A. | 丙烯 | B. | 2-戍烯 | C. | 苯乙烯 | D. | 1,3-丁二烯 |
19.已知如表数据:
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
9.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+2CO2 | D. | NaOH+HCl═NaCl+H2O |
13.元素X的原子,其M层与K层电子数相同;元素Y的原子,其层上有5个电子.X和Y所形成的稳定化合物的式量为( )
| A. | 100 | B. | 90 | C. | 88 | D. | 80 |
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |