题目内容
19.能说明BF3分子中的4个原子处于同一平面的理由是( )| A. | 3个B-F的键能相同 | B. | 3个B-F的键长相同 | ||
| C. | 3个B-F的键角均为120° | D. | 3个B-F的键均为σ键 |
分析 根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,BF3中B原子SP2杂化,分子构型为平面三角形,4个原子处于同一平面,所以3个B-F的键角均为120°能说明BF3分子中的4个原子处于同一平面,据此分析解答.
解答 解:BF3分子中价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3形成了三条杂化轨道,即B的杂化类型为sp2,形成3个共用电子对,无孤对电子,所以该分子是平面三角形结构,
A.3个B-F键相同,键能相同,不能说明BF3分子中的4个原子处于同一平面,故A错误;
B.3个B-F键相同,键长相同,不能说明BF3分子中的4个原子处于同一平面,故B错误;
C.BF3中B原子SP2杂化,分子构型为平面三角形,则其分子结构必然是三个F原子分别处在以硼为中心的平面三角形的三个顶点上,所以当3个B-F的键角均为120°,能说明BF3分子中的4个原子处于同一平面,故C正确;
D.单键为σ键,3个B-F的键均为σ键,但不能说明BF3分子中的4个原子处于同一平面,故D错误;
故选C.
点评 本题主要考查有机化合物的结构特点和分子的结构,做题时注意从杂化方式以及键长、键角等判断分子的空间结构,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+2CO2 | D. | NaOH+HCl═NaCl+H2O |
10.乙醇、甘油和苯酚所具有的共同点是( )
| A. | 都易溶于水 | B. | 都能与NaOH溶液反应 | ||
| C. | 分子结构中都含有羟基 | D. | 都属于醇类化合物 |
7. 在结构化学中,可将晶体结构截分为一个个包含等同内容的基本单位,这个基本单位叫做晶胞.钙、钛、氧可以形成 如图所示的晶胞,则该物质的化学式可表示为( )
在结构化学中,可将晶体结构截分为一个个包含等同内容的基本单位,这个基本单位叫做晶胞.钙、钛、氧可以形成 如图所示的晶胞,则该物质的化学式可表示为( )
 在结构化学中,可将晶体结构截分为一个个包含等同内容的基本单位,这个基本单位叫做晶胞.钙、钛、氧可以形成 如图所示的晶胞,则该物质的化学式可表示为( )
在结构化学中,可将晶体结构截分为一个个包含等同内容的基本单位,这个基本单位叫做晶胞.钙、钛、氧可以形成 如图所示的晶胞,则该物质的化学式可表示为( )| A. | Ca8TiO12 | B. | Ca4TiO6 | C. | Ca4TiO3 | D. | CaTiO3 |
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
9.下列关于元素周期表的叙述正确的是( )
| A. | 同周期元素的电子层数相等 | |
| B. | 同族元素的最外层电子数一定相等 | |
| C. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
 如图所示,
如图所示,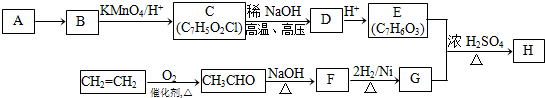
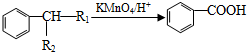 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);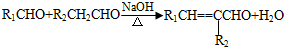 ;
;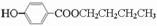 .
.
 ,名称是3-甲基-1-丁炔;
,名称是3-甲基-1-丁炔;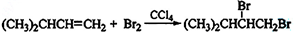 ;
;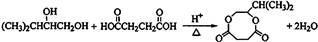 ;
;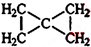 .
.