题目内容
5.工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
(1)合成 1mol NH3(l)放出(填“吸收”、“放出”)b+c-akJ的热量.
(2)已知:拆开 lmol H-H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ.则上图中的 a=1127kJ;1mol N2(g) 完全反应生成NH3(g)产生的能量变化为92KJ.
(3)推测反应 2NH3(l)=2N2 (g)+3H2(g) 比反应2NH3(g)=2N2 (g)+3H2(g)吸收(填“吸收”、“放出”)的热量多(填“多”、“少”).
分析 (1)根据能量变化图,合成1mol NH3(l)则放出的热量等于(b+c-a)KJ;
(2)上图中的a等于断裂0.5mol氮气和1.5mol氢气所吸收的热量;1mol N2(g) 完全反应生成NH3(g)产生的能量变化为反应物的键能之和-生成物的键能之和;
(3)根据液体氨气转化为气态还要吸热判断.
解答 解:(1)由能量变化图,合成1mol NH3(l)则放出的热量等于(b+c-a)KJ,故答案为:放出;b+c-a;
(2)上图中的a等于断裂0.5mol氮气和1.5mol氢气所吸收的热量,即946×0.5+436×1.5=1127KJ;1mol N2(g) 完全反应则消耗3mol氢气生成2molNH3(g)产生的能量变化为946+436×3-391×6=-92KJ,故答案为:1127;92;
(3)因为合成 NH3则放出热量,所以氨气分解则吸收热量,又液体氨气转化为气态还要吸热,所以液态氨分解吸收的热量比气态氨吸收的热量多,故答案为:吸收;多.
点评 本题考查反应热与能量变化,侧重于考查学生的分析能力和自学能力,题目难度不大,注意把握题给图象信息,答题时注意仔细审题.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
15.核电荷数为1~18的元素中,下列叙述正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |
13.元素X的原子,其M层与K层电子数相同;元素Y的原子,其层上有5个电子.X和Y所形成的稳定化合物的式量为( )
| A. | 100 | B. | 90 | C. | 88 | D. | 80 |
20.下列叙述中正确的是( )
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
10.乙醇、甘油和苯酚所具有的共同点是( )
| A. | 都易溶于水 | B. | 都能与NaOH溶液反应 | ||
| C. | 分子结构中都含有羟基 | D. | 都属于醇类化合物 |
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
15.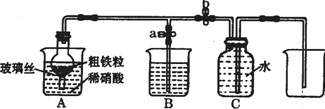 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.
①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.