题目内容
9.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
分析 非金属元素R,其质量数为127,又知R离子含有74个中子,则R原子质子数为127-74=53,R离子有54个电子,则离子带一个单位负电荷,故R元素最高正化合价为+7,进而书写最高价氧化物化学式.
解答 解:非金属元素R,其质量数为127,又知R离子含有74个中子,则R原子质子数为127-74=53,R离子有54个电子,则离子带一个单位负电荷,即R元素最低负化合价为-1,故R元素最高正化合价为8-1=+7,则R氧元素最高价氧化物化学式为R2O7,故选B.
点评 本题考查原子结构与元素性质,难度不大,注意理解离子核外电子数、质子数与所带电荷关系.

练习册系列答案
相关题目
19.已知如表数据:
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
20.下列叙述中正确的是( )
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
4.下列说法正确的是( )
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键.
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键.
| A. | ②③ | B. | ②③⑤ | C. | ③④ | D. | ①②④ |
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
18.A元素的最高正价和最低负价的绝对值之差为6,B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是( )
| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
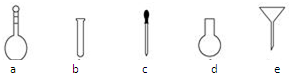 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+. .
.
 .
.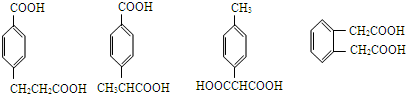 任意一种.
任意一种.