题目内容
6.同族元素所形成的同类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
分析 根据题意可知,化合物PH4I的结构和性质应与NH4Cl相似,NH4Cl是离子化合物,受热易分解,据此分析.
解答 解:化合物PH4I的结构和性质应与NH4Cl相似,NH4Cl是离子化合物,受热易分解,则
A.PH4I为离子化合物,故A错误;
B.PH4I不稳定,受热分解,故B错误;
C.由NH4Cl的性质可知,与碱反应生成PH3,故C错误;
D.由NH3和HCl反应生成NH4Cl,可知PH3和HI化合生成PH4I,故D正确.
故选D.
点评 本题考查信息迁移题目,题目难度不大,注意同族元素所形成的同一类型的化合物,其结构和性质往往相似这一点,根据NH4Cl的性质对比解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
18.A元素的最高正价和最低负价的绝对值之差为6,B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是( )
| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
15.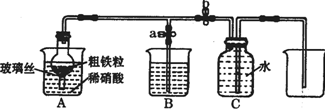 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.
①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
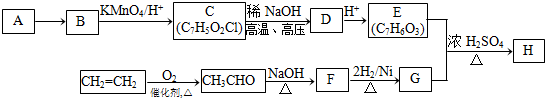
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.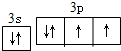 .
.
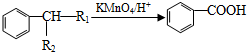 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);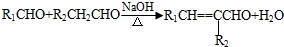 ;
;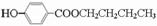 .
.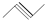 ②
②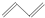 ③
③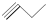 ④
④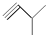 ⑤
⑤ .请按要求填空:
.请按要求填空: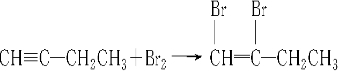 .
.