题目内容
4.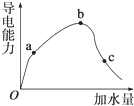 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:(1)O点为什么不导电:因为冰醋酸未电离,无自由移动的离子.
(2)a、b、c三点溶液的pH由小到大的顺序是b<a<c.
(3)H+的物质的量最大的是c(填“a”、“b”或“c”).
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的ACE(填序号).
A.加热 B.加很稀的NaOH溶液 C.加NaOH固体
D.加水 E.加入锌粒.
分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)溶液越稀,越促进醋酸电离;
(4)要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:因为冰醋酸未电离,无自由移动的离子;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度由小到大的顺序为为c<a<b,则pH由小到大的顺序是b<a<c,
故答案为:b<a<c;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,所以氢离子的物质的量最大的是c,故答案为:c;
(4)A.加热促进醋酸电离,则溶液中醋酸根离子浓度增大,故正确;
B.加很稀的NaOH溶液,促进醋酸电离,但溶液的体积增大,导致醋酸根离子浓度减小,故错误;
C.加NaOH固体,氢氧化钠和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;
D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
E.加入锌粒,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;
故答案为:ACE.
点评 本题综合考查电解质的电离,侧重于学生的分析能力的考查,注意加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.

练习册系列答案
相关题目
14.下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是( )
| A. | 同周期元素的原子半径随着核电荷数的增大而增大 | |
| B. | 同主族元素的原子半径随着核电荷数的增大而增大 | |
| C. | 同周期元素的第一电离能随着核电荷数的增大而增大 | |
| D. | 同主族元素的第一电离能随着核电荷数的增大而增大 |
15.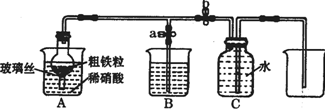 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.
①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
9.下列关于元素周期表的叙述正确的是( )
| A. | 同周期元素的电子层数相等 | |
| B. | 同族元素的最外层电子数一定相等 | |
| C. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
13.关于乙烯的化学性质,说法正确的是( )
| A. | 能发生聚合反应 | B. | 能使溴水褪色 | ||
| C. | 可与H2发生加成反应 | D. | 可与HCl加成 |
 .
.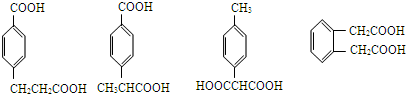 任意一种.
任意一种.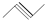 ②
②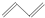 ③
③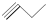 ④
④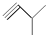 ⑤
⑤ .请按要求填空:
.请按要求填空: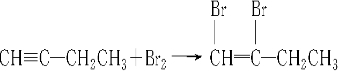 .
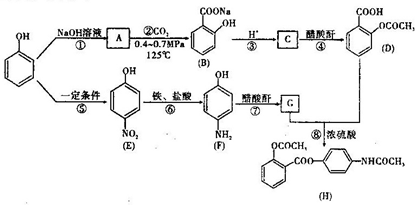
.
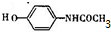 .
.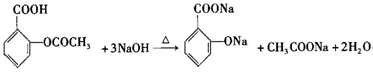 .
.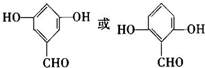 .
.