题目内容
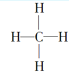
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

【答案】 CH4 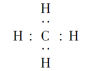
 正四面体结构
正四面体结构 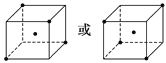
【解析】(1)该烃的物质的量为n=2.8 L/22.4 L·mol1=0.125 mol,该烃的摩尔质量M=2 g/0.125 mol=16 g·mol1,1 mol该烃中含氢原子的物质的量为n(H)=16 g×25%÷1 g·mol1=4 mol,含碳原子的物质的量为n(C)=16 g×![]() =1 mol,所以分子式为CH4。
=1 mol,所以分子式为CH4。
(2)CH4分子是以碳原子为中心的正四面体结构,在立方体中互不相邻的四个顶点即构成正四面体结构。

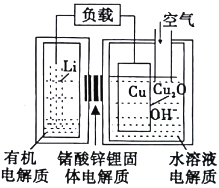
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
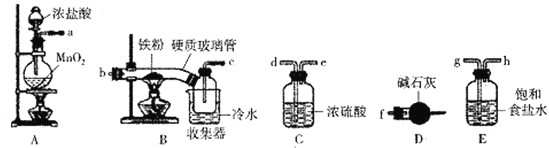
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
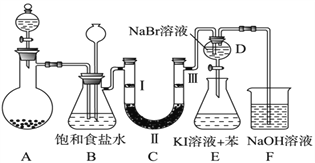
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:______。装置B中饱和食盐水的作用是________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |