题目内容
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
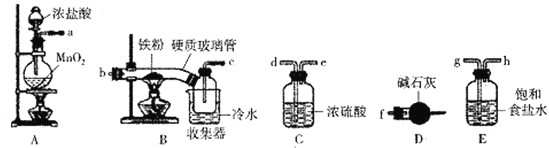
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
【答案】 MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O aghdebcf 冷却使FeCl3沉积,便于收集 使沉积在B中硬质玻璃管的有端的FeCl3进入收集器 溶液出现血红色 酸性KMnO4溶液 含有Fe2+ 2000
Mn2+Cl2↑+2H2O aghdebcf 冷却使FeCl3沉积,便于收集 使沉积在B中硬质玻璃管的有端的FeCl3进入收集器 溶液出现血红色 酸性KMnO4溶液 含有Fe2+ 2000
【解析】(1)A装置制取氯气,装置A中发生的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O;(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;故答案为:a,g,h,d,e,b,c,f; (3)装置B中收集器放在冷水中的作用为:冷却使FeCl3沉积,便于收集;(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,三氯化铁升华,其目的是:使沉积在B中硬质玻璃管的有端的FeCl3进入收集器;(5)①取少许上述溶液,溶液中有铁离子,加入KSCN溶液,溶液出现血红色,检验溶液中的铁离子;②取少许上述溶液,含有亚铁离子,加入酸性KMnO4溶液,紫红色褪去,说明溶液中含有亚铁离子;(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为
Mn2+Cl2↑+2H2O;(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;故答案为:a,g,h,d,e,b,c,f; (3)装置B中收集器放在冷水中的作用为:冷却使FeCl3沉积,便于收集;(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,三氯化铁升华,其目的是:使沉积在B中硬质玻璃管的有端的FeCl3进入收集器;(5)①取少许上述溶液,溶液中有铁离子,加入KSCN溶液,溶液出现血红色,检验溶液中的铁离子;②取少许上述溶液,含有亚铁离子,加入酸性KMnO4溶液,紫红色褪去,说明溶液中含有亚铁离子;(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为
2FeCl3 + H2S=2FeCl2+2HCl+S↓
2mol 34g
V×5.0mol·L-1 170g
![]()
V=2L=2000mL

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
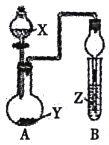
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D