题目内容
【题目】将1.76g铜镁合金完全溶解于一定浓度的硝酸中,得到NO和NO2标准状况下896mL的混合气体,向反应后的溶液中加入lmol/L的NaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A. 合金中铜镁物质的最之比为1:1
B. 产生的NO和NO2的体积之比为1:1
C. 得到3.12g沉淀时,加入NnOH溶液体积一定是80mL
D. 1.76g该合金与足量盐酸反应,可生成标准状况下448mL气体
【答案】C
【解析】A、设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知x×64 g/mol+y×24 g/mol=1.76g①;n(OH-)=![]() =0.08mol,故2x+2y=0.08 mol②,由①②解得x=0.02 mol,y=0.02 mol,选项A正确;B、铜镁的物质的量都为0.02mol,与硝酸反应失电子数目为0.08mol,HNO3得电子还原为NO和NO2,设其物质的量分别为a、b,则有22400mL/mol(a+b)=896mL,3a+b=0.08mol,解得a=0.02 mol,b=0.02 mol,故体积之比为1:1,选项B正确;C、得到3.12g沉淀时,除与Mg2+、Cu2+反应消耗0.08molNaOH,原溶液中可能还有剩余的HNO3也消耗NaOH,故加入NaOH溶液体积可能大于80mL,选项C错误;D、1.76g该合金中的0.02molMg可与盐酸反应,生成0.02molH2,即准状况下448mL气体,选项D正确。答案选C。
=0.08mol,故2x+2y=0.08 mol②,由①②解得x=0.02 mol,y=0.02 mol,选项A正确;B、铜镁的物质的量都为0.02mol,与硝酸反应失电子数目为0.08mol,HNO3得电子还原为NO和NO2,设其物质的量分别为a、b,则有22400mL/mol(a+b)=896mL,3a+b=0.08mol,解得a=0.02 mol,b=0.02 mol,故体积之比为1:1,选项B正确;C、得到3.12g沉淀时,除与Mg2+、Cu2+反应消耗0.08molNaOH,原溶液中可能还有剩余的HNO3也消耗NaOH,故加入NaOH溶液体积可能大于80mL,选项C错误;D、1.76g该合金中的0.02molMg可与盐酸反应,生成0.02molH2,即准状况下448mL气体,选项D正确。答案选C。

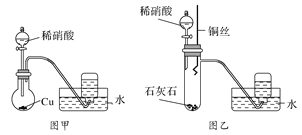
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
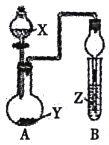
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D