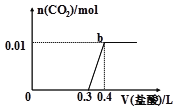
题目内容
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
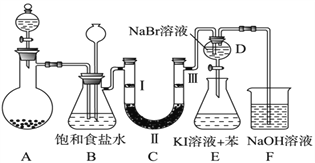
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:______。装置B中饱和食盐水的作用是________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【答案】 4HCl(浓)+MnO2 ![]() MnCl2 +Cl2↑+H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱 d
MnCl2 +Cl2↑+H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱 d
【解析】考查实验方案设计与评价,(1)利用MnO2和浓盐酸制备氯气的反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O;装置A制备的氯气中混有HCl和水蒸气,因此装置B中饱和食盐水的作用是除去氯气中的HCl,如果C中发生堵塞,装置A继续产生气体,装置中的压强增大,B中长颈漏斗中液面上升,形成水柱;(2)验证氯气是否具有漂白性,先应是湿润的有色布条、干燥剂、干燥的有色布条,因为是U型管,盛放的干燥剂应为固体,因此选项d正确。
MnCl2+Cl2↑+H2O;装置A制备的氯气中混有HCl和水蒸气,因此装置B中饱和食盐水的作用是除去氯气中的HCl,如果C中发生堵塞,装置A继续产生气体,装置中的压强增大,B中长颈漏斗中液面上升,形成水柱;(2)验证氯气是否具有漂白性,先应是湿润的有色布条、干燥剂、干燥的有色布条,因为是U型管,盛放的干燥剂应为固体,因此选项d正确。

 阅读快车系列答案
阅读快车系列答案【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.