题目内容
8.元素A的单质能与H2化合生成HxA,在标准状况下8.5g HxA气体的体积是5.6L.含有5.1g HxA的溶液与200mL 0.75mol/L的CuCl2溶液正好完全反应,并生成黑色沉淀,则:(1)A元素的相对原子质量是32,若A的质子数等于中子数,则A是S元素.
(2)A的最高价氧化物是SO3,室温下呈液态,其分子由共价键结合而成.
(3)写出HxA的电子式
 .
.(4)HxA与CuCl2溶液反应的离子方程式为H2S+Cu2+=CuS↓+2H+.
分析 在标准状况下8.5g HxA气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故HxA的相对分子质量为$\frac{8.5}{0.25}$=34,含5.1g HxA的物质的量为$\frac{5.1g}{34g/mol}$=0.15mol,CuCl2的物质的量为0.2L×0.75mol/L=0.15mol,二者正好完全反应,生成黑色沉淀,则HxA中A表现-2价,故x=2,则A的相对原子质量,34-2=32,若A的质子数等于中子数,可推知A为S元素,据此解答.
解答 解:(1)在标准状况下8.5g HxA气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故HxA的相对分子质量为$\frac{8.5}{0.25}$=34,含5.1g HxA的物质的量为$\frac{5.1g}{34g/mol}$=0.15mol,CuCl2的物质的量为0.2L×0.75mol/L=0.15mol,二者正好完全反应,生成黑色沉淀,则HxA中A表现-2价,故x=2,则A的相对原子质量,34-2=32,若A的质子数等于中子数,可推知A为S元素,故答案为:32;S;
(2)硫元素的最高价氧化物是SO3,室温下呈液态,其分子由共价键结合而成,故答案为:SO3;液态;共价;
(3)化合物HxA为H2S,电子式为: ,故答案为:
,故答案为: ;
;
(4)HxA与CuCl2溶液反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,故答案为:H2S+Cu2+=CuS↓+2H+.
点评 本题考查元素化合物推断,属于计算型推断,难度不大,注意三氧化硫的熔沸点.

练习册系列答案
相关题目
18.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
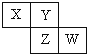

| A. | Z单质的化学活泼性一定比Y单质的强 | |
| B. | W的原子序数可能是Y的原子序数的2倍 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | X和W两元素不可能形成共价化合物 |
19.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 淀粉可用于制备葡萄糖、酿制食醋,还可作药片的赋形剂 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
16.下列各项实验的基本操作中,正确的是( )
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |
20. 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )| A. | 原子半径:Z<Y<W | |
| B. | 最简单气态氢化物的热稳定性:Y<W | |
| C. | 含X的化合物形成的溶液一定呈酸性 | |
| D. | Y的最简单阴离子和Z的最简单阳离子核外电子数相同 |
17.某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4震荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO32- | ||
| C. | 可能含有的离子是Cl-、Br-、SO42- | D. | 不能确定的离子是Cl-、SO42- |
3. 向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
 向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
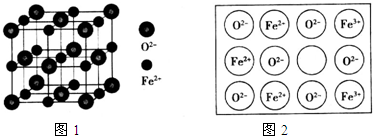
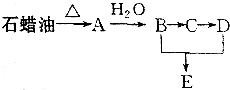 某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空:
某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空: CH3COOCH2CH3+H2O,反应类型为酯化反应.
CH3COOCH2CH3+H2O,反应类型为酯化反应.