题目内容
20.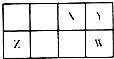 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )| A. | 原子半径:Z<Y<W | |
| B. | 最简单气态氢化物的热稳定性:Y<W | |
| C. | 含X的化合物形成的溶液一定呈酸性 | |
| D. | Y的最简单阴离子和Z的最简单阳离子核外电子数相同 |
分析 Y元素在地壳中的含量最高,则Y为O元素,由元素在周期表中相对位置,可知X为N元素、W为S元素、Z为Al.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
B.非金属性越强,氢化物越稳定;
C.氨气水溶液呈碱性;
D.O2-、Al3+离子核外电子数均为10.
解答 解:Y元素在地壳中的含量最高,则Y为O元素,由元素在周期表中相对位置,可知X为N元素、W为S元素、Z为Al.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Z>Y>W,故A错误;
B.氢化物稳定性与元素非金属一致,同主族自上而下非金属性减弱,氢化物稳定性减弱,故B错误;
C.硝酸溶液呈酸性,硝酸钠溶液呈中性,氨气水溶液呈碱性,含有氮元素的溶液可能呈酸性、中性或碱性,故C错误;
D.O2-、Al3+离子核外电子数均为10,故D正确,
故选D.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意对元素周期表的理解掌握,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.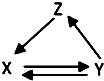 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |
11.设NA 为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
15.分了式为C6H12O2并能与NaHCO3发生反应生成气体的有机物有x种(不包括立体异构,下同),分子式为C5H12O并能与Na发生反应的有机物有y种,则x和y的关系为( )
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
9.在实验室中,下列除去杂质的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有HNO3和H2SO4,将其倒入NaOH溶液中,静止,分液 | |
| D. | 乙烯中混有SO2,将其通入酸性高锰酸钾溶液中洗气 |
15.下列有关物质性质和应用正确的是( )
| A. | 甲醛能使蛋白质变性,可用于食品防腐剂 | |
| B. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | 硅酸钠溶液呈碱性,常用作木材的防火剂 | |
| D. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
 .
.