题目内容
14.某气态烷烃与丙炔的混合气体22.4L,完全燃烧后生成121g二氧化碳和40.5g水,则原混合气体中烷烃的分子式为C2H6.分析 混合气体22.4L,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,n(CO2)=$\frac{121g}{44g/mol}$=2.75g,n(H2O)=$\frac{40.5g}{18g/mol}$=2.25mol,根据混合物的平均分子式确定烷烃的可能性,以此解答.
解答 解:混合气体22.4L,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,n(CO2)=$\frac{121g}{44g/mol}$=2.75g,n(H2O)=$\frac{40.5g}{18g/mol}$=2.25mol,
则混合物的平均分子式为C2.75H4.5,已知一种气体为丙炔,分子式为C3H4,
可知烷烃中C<2.75,H>4,则只有C2H6符合.
故答案为:C2H6.
点评 本题考查有关混合物反应的计算,题目难度中等,根据题干信息计算出平均分子式为解答关键,注意讨论法、平均分子式法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列说法正确的是( )
| A. | 含有CH3COONa的溶液都能增大水的电离程度 | |
| B. | pH=5的HCl与pH=5的NH4Cl等体积混合,溶液pH仍为5 | |
| C. | 将AgI和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,产生的沉淀主要是AgBr | |
| D. | 20mL0.1mol/LNH3•H2O与10mL0.1mol/LHCl充分反应,所得溶液pH=9中c(NH3•H2O)>c(Cl-)>c(OH-) |
5.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是( )
| A. | H2S | B. | O2 | C. | H2S、SO2 | D. | SO3 |
9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W形成的简单离子具有相同电子层结构,其离子半径依次增大 | |
| B. | X、Z、R三种元素构成的化合物中只含离子键 | |
| C. | 元素Z、R氧化物对应的水化物之间相互反应,生成的盐溶液只能呈中性 | |
| D. | 元素Y气态氢化物的稳定性强于元素R |
3.下列说法正确的是( )
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
7.aX、bY、dZ、W是四种短周期主族元素(只有一种是金属),b-a=d-b=1,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,下列说法中正确的是( )
| A. | Q中只有离子键 | |
| B. | 原子半径W>Z>Y>X | |
| C. | Y元素可形成两种含氧酸,且这两种含氧酸均为强酸 | |
| D. | 最简单氢化物的稳定性Z>Y>X,沸点Z>Y>X |
8.下列离子方程式书写正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
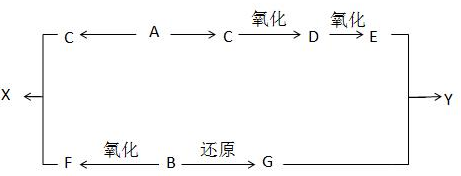
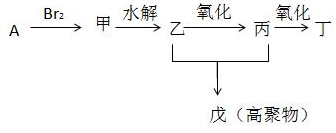
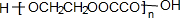
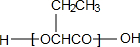 .
.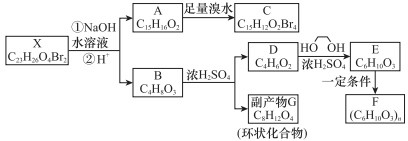
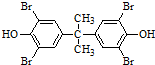 ,化合物C的1H-NMR谱的峰面积之比为1:2:3(按从小到大的顺序填写)
,化合物C的1H-NMR谱的峰面积之比为1:2:3(按从小到大的顺序填写) .
.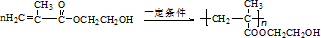 .
.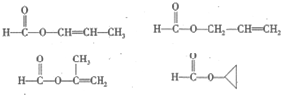 .
.