题目内容
5.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是( )| A. | H2S | B. | O2 | C. | H2S、SO2 | D. | SO3 |
分析 H2S和O2的混合气体点燃后充分反应,如氧气足量发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,剩余气体可能为SO2或二者都有;如氧气不足,发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,剩余气体H2S,以此解答该题.
解答 解:①如氧气足量,则发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应100mL-10mL=90mL,则反应的H2S体积为90mL×$\frac{2}{5}$=36mL,
则生成SO2的体积为36mL>10mL,不符合题意;
②若生成产物为SO2和S,则SO2为10ml,
则先后发生 2H2S+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2S+2H2O
$\frac{2}{3}$×90ml $\frac{1}{3}$×90ml
S+O2 $\frac{\underline{\;点燃\;}}{\;}$ SO2,
10ml 10ml
即H2S为60mL,O2为40mL,二者体积之和为100ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,
H2S和O2共反应100mL-10mL=90mL,
则H2S为90mL×$\frac{2}{3}$+10mL=70mL,O2为90mL×$\frac{1}{3}$mL=30mL,二者体积之和为100ml,符合题意,
选项中只有A符合.
故选A.
点评 本题考查了混合物的计算,该题是基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力,难度中等.

| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
 与
与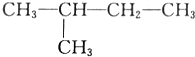 ⑤
⑤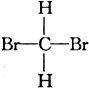 与CH2Br2⑥
与CH2Br2⑥ 与
与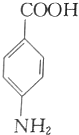
请用序号填写下表.
| 类别 | 同分异构体 | 同位素 | 同素异形体 | 同种物质 |
| 组别 |




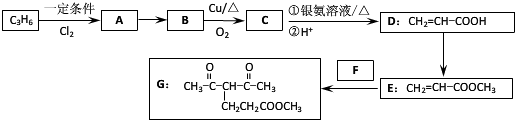
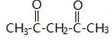 .
.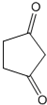 +CH2=CH-NO2$\stackrel{一定条件}{→}$
+CH2=CH-NO2$\stackrel{一定条件}{→}$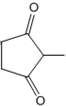 CH2CH2NO2
CH2CH2NO2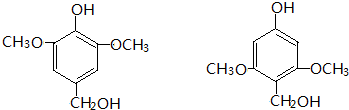 .
.