题目内容
9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )| A. | 元素Y、Z、W形成的简单离子具有相同电子层结构,其离子半径依次增大 | |
| B. | X、Z、R三种元素构成的化合物中只含离子键 | |
| C. | 元素Z、R氧化物对应的水化物之间相互反应,生成的盐溶液只能呈中性 | |
| D. | 元素Y气态氢化物的稳定性强于元素R |
分析 X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此解答.
解答 解:X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素.
A.Y、Z、W元素形成的简单离子分别为O2-、Na+、Al3+,O2-、Na+、Al3+具有相同电子层结构,离子半径随着核电荷数的增大而减小,所以离子半径O2->Na+>Al3+,故A错误
B.X、Z、R三种元素构成的化合物为NaHS,含有离子键、共价键,故B错误;
C.Z的氧化物对应水化物为NaOH,R元素的氧化物的水化物为H2SO3、H2SO4,相互反应可以得到亚硫酸氢钠、硫酸氢钠、亚硫酸钠、硫酸钠,酸式盐溶液呈酸性,亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性,故C正确;
D.非金属性O>S,故氢化物稳定性H2O>H2S,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度中等,注意半径比较规律,注意对基础知识的理解掌握.

| A. | 某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol | |
| B. | 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c | |
| C. | 已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 | |
| D. | 在25℃下,将2a mol•L-1的氨水与0.02 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{10-9}{a-0.01}$ |
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
 与
与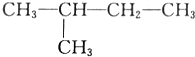 ⑤
⑤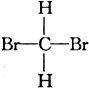 与CH2Br2⑥
与CH2Br2⑥ 与
与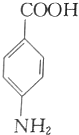
请用序号填写下表.
| 类别 | 同分异构体 | 同位素 | 同素异形体 | 同种物质 |
| 组别 |
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
| A. | CH4与C3H8 | B. | 苯与己烯 | C. | 己烷与苯 | D. | 苯与甲苯 |
| A. | 已知白磷(P4)为正四面体形,12.4 g白磷中则含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在0.1 mol/L碳酸钠溶液中Na+总数等于0.2 NA | |
| D. | 电解精炼铜时,当电路中转移NA个电子时,阴极增重32g |
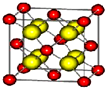 已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,
, .
.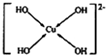 (需要用箭头指出配位键).
(需要用箭头指出配位键).