题目内容
7.aX、bY、dZ、W是四种短周期主族元素(只有一种是金属),b-a=d-b=1,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,下列说法中正确的是( )| A. | Q中只有离子键 | |
| B. | 原子半径W>Z>Y>X | |
| C. | Y元素可形成两种含氧酸,且这两种含氧酸均为强酸 | |
| D. | 最简单氢化物的稳定性Z>Y>X,沸点Z>Y>X |
分析 aX、bY、dZ、W是四种短周期主族元素,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,Q为Na2O2,由于b-a=d-b=1,四元素只有一种是金属,故W为Na,Z为O元素,Y为N元素,X为C元素,据此解答.
解答 解:aX、bY、dZ、W是四种短周期主族元素,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,Q为Na2O2,由于b-a=d-b=1,四元素只有一种是金属,故W为Na,Z为O元素,Y为N元素,X为C元素.
A.Q为Na2O2,含有离子键、共价键,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:W(Na)>X(C)>Y(N)>Z(O),故B错误;
C.Y元素可形成硝酸、亚硝酸,硝酸属于强酸,亚硝酸属于弱酸,故C错误;
D.由于非金属性:Z(O)>Y(N)>X(C),故最简单氢化物的稳定性Z>Y>X,常温下水为液态,而甲烷、氨气为气体,故水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷,故氢化物沸点Z>Y>X,故D正确,
故选:D.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,注意对元素化合物性质的掌握,注意氢键对物质性质的影响.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
13.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
15.下列说法不正确的是( )
| A. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度;量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | pH计能用于酸碱中和滴定终点的判断 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
12.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好被500mL 2.0mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量是( )
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
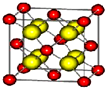 已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,
, .
.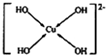 (需要用箭头指出配位键).
(需要用箭头指出配位键).
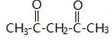 .
.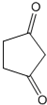 +CH2=CH-NO2$\stackrel{一定条件}{→}$
+CH2=CH-NO2$\stackrel{一定条件}{→}$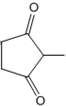 CH2CH2NO2
CH2CH2NO2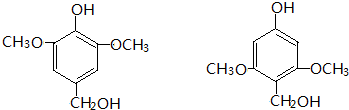 .
.
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题: