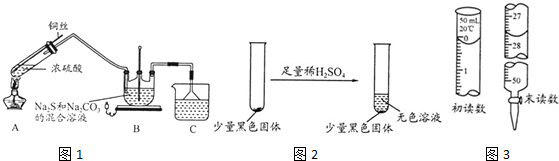
题目内容
8.某学习小组通过查阅资料得知,CO2与Na2O2之间的反应需要在一定量的水蒸气存在的条件下才能进行,于是他们设计了下列装置对此的问题进行探.同时验证Na2O2与CO2反应的气体产物.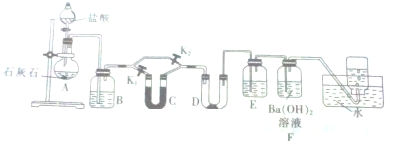
(1)装置A中有关反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑.装置B中的试剂是饱和碳酸氢钠,装置E的作用是防止F中的水蒸气进入D,F的作用是吸收多余的CO2.
(2)U形管C中的试剂是碱石灰.若要求根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下进行,对两个止水夹进行如下操作:先打开K1,关闭K2,对应的实验现象是D中过氧化钠固体的颜色不变,后打开K2,关闭K1,对应的实验现象是D中过氧化钠固体的颜色由浅黄色变为白色.
分析 碳酸钙与稀盐酸反应生成二氧化碳,二氧化碳通过盛有饱和碳酸氢钠溶液的洗气瓶,除去杂质HCl,再通过干燥管C干燥,或者不通过C直接进入盛有过氧化钠的D中,E中的盛有浓硫酸可以防止F中的水蒸气进入D中干扰实验,用氢氧化钡溶液吸收多余的二氧化碳,最后用排水法收集氧气;
(1)碳酸钙与稀盐酸反应生成二氧化碳、氯化钙和水;装置B的作用是吸收二氧化碳中的杂质HCl;F中的水蒸气进入D中会干扰实验;用氢氧化钡溶液吸收多余的二氧化碳;
(2)由分析可知,U形管C是干燥二氧化碳;根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下进行,则二氧化碳通过干燥管C干燥,或者不通过C直接进入盛有过氧化钠的D中,看D中固体颜色变化来判断.
解答 解:(1)碳酸钙与稀盐酸反应生成二氧化碳、氯化钙和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
装置B的作用是吸收二氧化碳中的杂质HCl,所以B中的试剂为饱和碳酸氢钠;F中的水蒸气进入D中会干扰实验,所以E中中盛有浓硫酸以便防止F中的水蒸气进入D中与过氧化钠反应;最后用排水法收集生成的氧气,其中多余的二氧化碳要用氢氧化钡溶液吸收,则F的作用是吸收多余的CO2;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;饱和碳酸氢钠;防止F中的水蒸气进入D;吸收多余的CO2;
(2)由分析可知,U形管C是干燥二氧化碳,则C中的试剂是碱石灰;打开K1,关闭K2,二氧化碳先进入U形管C中干燥,再进入D中,若D中过氧化钠固体的颜色不变,说明干燥的二氧化碳与过氧化钠不反应;打开K2,关闭K1,二氧化碳不通过C直接进入盛有过氧化钠的D中,D中过氧化钠固体的颜色由浅黄色变为白色,则湿润的二氧化碳气体与过氧化钠能发生反应;
故答案为:碱石灰;K1,K2,D中过氧化钠固体的颜色不变;K2,K1,D中过氧化钠固体的颜色由浅黄色变为白色.
点评 本题考查了过氧化钠的有关性质的探究实验,侧重于考查反应装置、除杂装置、干燥装置、反应原理等,综合性比较强,题目难度中等.主要考查学生的实验探究能力和分析问题、解决问题的能力.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④过氧化氢和液氮的分子中都有非极性共价键
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥在熔化状态和水溶液中均不能导电的物质称为非电解质.
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
①B+H2O $\stackrel{电解}{→}$ C+H2↑ ②A→B+NaCl ③E+NaOH→B+C+H2O ④D+NaOH→A+B+H2O
这五种化合物中含氯的化合价由高到低的顺序为( )
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
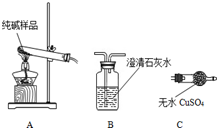 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |