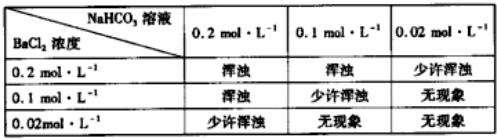
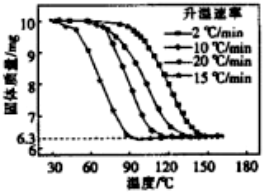
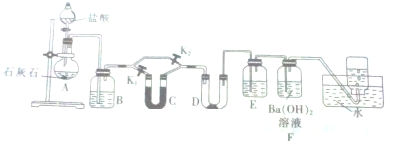
题目内容
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
分析 A、1molNH4NO3中含2mol氮原子;
B、羟基不显电性;
C、乙二醇为二元醇,1mol乙二醇含2mol羟基;
D、常温常压下,气体摩尔体积不是22.4L/mol.
解答 解:A、1L0.1mol/L的NH4NO3溶液的物质的量n=CV=1L×0.1mol/L=0.1mol,而1molNH4NO3中含2mol氮原子,故0.1molNH4NO3中含0.2mol氮原子,即0.2NA个,故A正确;
B、羟基不显电性,故1mol羟基含9mol电子,即9NA个电子,故B错误;
C、乙二醇为二元醇,1mol乙二醇含2mol羟基,故与钠反应生成1mol氢气,故C正确;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L乙烯的物质的量小于1mol,故含有的C-H的物质的量小于4mol,即小于4NA个,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列有机物的命名正确的是( )
| A. | (CH3)2CHCH2CH(CH3)CH(CH3)2 2,4,5-三甲基己烷 | |
| B. | 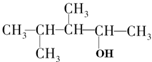 1,2,3-三甲基-1-丁醇 1,2,3-三甲基-1-丁醇 | |
| C. | CH2=C(CH3)CH2C(CH3)32,4,4-三甲基-1-戊烯 | |
| D. | CH3COOCH2CH2OOCCH3 乙二酸乙二酯 |
6.已知2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).是工业制H2SO4的一个重要的反应,控制此反应条件,使之向有利于生成SO3的反应方向进行,下列有关叙述错误的是( )
| A. | 使用催化剂(V2O5)可提高该反应的反应速率 | |
| B. | 定期抽走SO3,有利于提高SO3的产率 | |
| C. | 增大O2的浓度,有利于提高SO2的转化率 | |
| D. | 增大SO2的浓度,有利于提高SO2的转化率 |
13.有机物分子中,若有1个碳原子用4个单键与4个互不相同的原子或原子团相连,这样的碳原子称为“手性碳”.若烯烃 分子中含有手性碳,该烯烃的一个分子中至少含有的碳原子数是( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
3.决定化学反应速率的主要因素是( )
| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域