题目内容
1.下列物质的电子式书写正确的是( )①Ca(OH)2

 ②H2S
②H2S 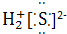
③OH-
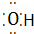 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N⑥CO2
 ⑦HClO
⑦HClO 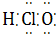 ⑧Na2O2
⑧Na2O2 
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
分析 ①Ca(OH)2为离子化合物; ②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键; ③OH-为带1个负电荷的阴离子;④Al3+,金属阳离子符号即为其电子式; ⑤N2 中N原子满足8个电子的稳定结构;⑥CO2 中C分别为O形成2对共价键;⑦HClO,HClO分子中存在H-O和O-Cl两个共价键;⑧Na2O2是钠离子和过氧根离子构成的离子化合物,据此解答即可.
解答 解:①Ca(OH)2 为离子化合物,电子式为:
 ,故正确;
,故正确;
②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故错误;
,故错误;
③氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为: ,故错误;
,故错误;
④Al3+,金属阳离子符号即为其电子式,故正确;
⑤N2中N原子满足8个电子的稳定结构,电子式为: ,故错误;
,故错误;
⑥CO2 中C分别为O形成2对共价键;⑦HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故错误;
,故错误;
⑧Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为: ,故正确,故正确的是:①④⑧,故选D.
,故正确,故正确的是:①④⑧,故选D.
点评 本题主要考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
12.下列实验能达到预期目的是( )
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
9.已知A、B、C、D、E是短周期中原子序数一次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
16.下列说法中正确的是( )
| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
6.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图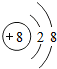 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式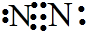 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
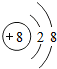 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式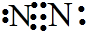 (用元素符号表示)
(用元素符号表示)(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.
10.某元素的两种同位素,它们的原子具有不同的( )
| A. | 质子数 | B. | 质量数 | C. | 原子序数 | D. | 电子数 |