题目内容
13.在硫酸铜溶液中加入过量的氢氧化钠溶液后,再滴入足量乙醛溶液,加热.实验过程中发生的反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4、CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+2Cu2O↓+3H2O.分析 硫酸铜溶液中滴入氢氧化钠溶液,产生蓝色沉淀氢氧化铜,乙醛具有醛基,能被氢氧化铜氧化,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水.
解答 解:硫酸铜溶液中滴入氢氧化钠溶液中生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+2Cu2O↓+3H2O.
点评 本题考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等,注意醛基的性质,题目难度不大.

练习册系列答案
相关题目
3.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定).

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
(1)滤渣a的成分是SiO2,用乙醇洗涤废催化剂的目的是溶解、除去有机物,从废渣中回收乙醇的方法是蒸馏.
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.
1.下列物质的电子式书写正确的是( )
①Ca(OH)2
 ②H2S
②H2S 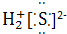
③OH-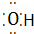 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
⑥CO2 ⑦HClO
⑦HClO 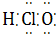 ⑧Na2O2
⑧Na2O2 
①Ca(OH)2

 ②H2S
②H2S 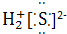
③OH-
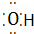 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N⑥CO2
 ⑦HClO
⑦HClO 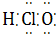 ⑧Na2O2
⑧Na2O2 
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
18.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入3mol/L的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 | |
| D. | 500mL 1mol/L的稀HCl与锌粒反应,将500mL 1mol/L的HCl改为1000mL 1mol/L的盐酸会使反应速率减慢 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
2.下列叙述正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | NCl3的电子式为 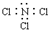 | ||
| C. | 甲酸乙酯的结构简式:C2H5OOCH | D. | 次氯酸的结构式H-Cl-O |
3.下列现象中所发生的现象与电子的跃迁无关的是( )
| A. | 燃放焰火 | B. | 霓虹灯广告 | C. | 燃烧蜡烛 | D. | 平面镜成像 |
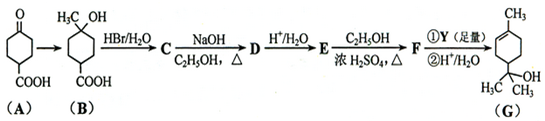
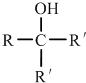
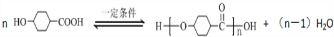
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应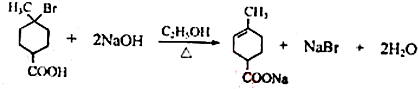 .
.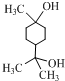 .
.