题目内容
11.某小组同学欲探究NH3催化氧化反应:4NH3+5O2$?_{△}^{催化剂}$ 4NO+6H2O,按如图1装置进行实验.
(1)装置A试管中的化合物X是Na2O2(填化学式).
(2)实验进行一段时间后,观察到装置G中溶液变成蓝色.用离子方程式解释G中溶液变蓝的原因3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)甲、乙两同学分别按上述装置进行实验.一段时间后,甲观察到装置F中有红棕色气体,乙则观察到装置F中只有白烟生成.该白烟的主要成分是NH4NO3(填化学式).
(4)为了帮助乙实现在装置F中也观察到红棕色气体生成,可在原实验基础上进行改进.
①甲认为是E反应后剩余O2太少导致F中无红棕色气体产生,预先在装置A试管内,除了NH4HCO3和X外,适当加入钠盐NaHCO3(填化学式)可以解决这个问题.
②乙则认为,可以在装置E、F之间增加一个装置,该装置如图2可以是abc(填标号).
分析 该实验探究NH3催化氧化反应,在催化剂条件下,氨气和氧气在E处发生氧化还原反应生成NO和水蒸气,所以A中生成的气体中含有氨气和氧气,加热碳酸氢铵时,发生反应NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+NH3↑,碳酸氢铵分解生成的气体中不含氧气,H2O、CO2和Na2O2反应生成O2,且除去杂质H2O、CO2,所以X为Na2O2,生成的NO是无色气体,NO不稳定易被氧化生成红棕色气体NO2,二氧化氮和水反应生成硝酸,硝酸和Cu反应生成硝酸铜、NO和水,氮氧化物有毒,不能直接排空,要连接尾气处理装置;
(1)装置A试管中的化合物X是Na2O2;
(2)实验进行一段时间后,观察到装置G中溶液变成蓝色,说明Cu发生氧化还原反应生成铜离子,二氧化氮和水反应生成的硝酸与铜发生氧化还原反应生成硝酸铜;
(3)甲、乙两同学分别按上述装置进行实验,一段时间后,甲观察到装置F中有红棕色气体说明有二氧化氮生成,乙则观察到装置F中只有白烟生成,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵固体;
(4)为了帮助乙实现在装置F中也观察到红棕色气体生成,可在原实验基础上进行改进.
①甲认为是E反应后剩余O2太少导致F中无红棕色气体产生,预先在装置A试管内,除了NH4HCO3和X外,适当加入钠盐,该钠盐能受热分解生成二氧化碳、水;
②乙则认为,可以在装置E、F之间增加一个装置,该装置要除去水蒸气.
解答 解:该实验探究NH3催化氧化反应,在催化剂条件下,氨气和氧气在E处发生氧化还原反应生成NO和水蒸气,所以A中生成的气体中含有氨气和氧气,加热碳酸氢铵时,发生反应NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+NH3↑,碳酸氢铵分解生成的气体中不含氧气,H2O、CO2和Na2O2反应生成O2,且除去杂质H2O、CO2,所以X为Na2O2,生成的NO是无色气体,NO不稳定易被氧化生成红棕色气体NO2,二氧化氮和水反应生成硝酸,硝酸和Cu反应生成硝酸铜、NO和水,氮氧化物有毒,不能直接排空,要连接尾气处理装置;
(1)装置A试管中的化合物X是Na2O2,故答案为:Na2O2;
(2)实验进行一段时间后,观察到装置G中溶液变成蓝色,说明Cu发生氧化还原反应生成铜离子,NO和氧气反应生成NO2,NO2和水反应生成的HNO3与Cu发生氧化还原反应生成硝酸铜、NO和水,铜离子呈蓝色,发生的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)甲、乙两同学分别按上述装置进行实验,一段时间后,甲观察到装置F中有红棕色气体说明有二氧化氮生成,乙则观察到装置F中只有白烟生成,E中生成NO和水,生成的NO被氧气氧化生成红棕色气体NO2,NO2和水反应生成HNO3,HNO3和氨气反应生成NH4NO3固体,所以白色固体成分是NH4NO3,故答案为:NH4NO3;
(4)为了帮助乙实现在装置F中也观察到红棕色气体生成,可在原实验基础上进行改进.
①甲认为是E反应后剩余O2太少导致F中无红棕色气体产生,预先在装置A试管内,除了NH4HCO3和X外,适当加入钠盐,该钠盐能受热分解生成二氧化碳、水,所以可以是NaHCO3,故答案为:NaHCO3;
②乙则认为,可以在装置E、F之间增加一个装置,该装置要除去水蒸气,a、b、c都可以吸收水蒸气且和NO不反应,故选abc.
点评 本题考查性质实验方案设计,为高考高频点,明确实验原理及物质性质是解本题关键,熟悉流程图中各个装置的作用,同时考查学生实验操作及实验分析能力,知道各个装置发生的反应,题目难度中等.

| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
(1)测定0.5mol•L-1盐酸与CaCO3固体的反应速率.
方案1:通过测定生成CO2的体积(或质量)和反应时间计算反应速率;
方案2:通过测定消耗CaCO3固体的质量和反应时间计算反应速率;
(2)探究固体表面积或反应物浓度对化学反应速率的影响.限选试剂与用品:0.5mol•L-1盐酸、块状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验:在固体表面积或反应物浓度不同的条件下,通过如图1实验装置测定生成等质量CO2所需的时间(或相同时间内生成的CO2的质量)来直接体现反应速率大小.

②参照下表格式,拟定实验表格,完整体现实验方案(写出所选试剂的状态及体积,需测定的物理量数据可用字母表示).
 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.
 .
.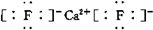 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.

 ②H2S
②H2S 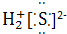
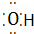 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N ⑦HClO
⑦HClO 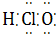 ⑧Na2O2
⑧Na2O2 