题目内容
3.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法.下列(2)中的物质并不能按照对应的分类标准与(1)中的物质归为一类的是( )| 选项 | (1) | (2) | 分类标准 |
| A | 盐酸、漂白粉、水玻璃、双氧水 | 氨水 | 混合物 |
| B | CH3COOH,H2CO3、HClO、NH3•H2O | HF | 弱电解质 |
| C | 电解反应、盐的水解、煤的干馏、石油裂化 | 钢铁生锈 | 化学变化 |
| D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.(1)中物质既包含混合物有保含纯净物;
B.在水溶液部分电离的电解质属于弱电解质;
C.化学变化必须有新物质生成;
D.能够与碱反应只生成盐和水的氧化物属于酸性氧化物.
解答 解:A.(1)中物质既包含混合物有保含纯净物,盐酸、漂白粉、水玻璃是混合物,双氧水是纯净物,不符合分类标准,故A选;
B.CH3COOH,H2CO3、HClO、NH3•H2O,都是弱电解质,氢氟酸为弱酸,水溶液中部分电离,属于弱电解质,符合题意,故B不选;
C.电解反应、盐的水解、煤的干馏、石油裂化都是化学变化,钢铁生锈有新物质生成属于化学变化,符合题意,故C不选;
D.CO2、SO3、P2O5、SiO2都是酸性氧化物,三氧化二铝既能与酸又能与碱反应,且产物都是盐和水,属于两性氧化物,不符合题意,故D选;
故选:AD.
点评 本题考查了物质的分类,明确分类标准,熟悉混合物、弱电解质、化学变化、酸性氧化物的概念即可解答,题目难度不大.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | 乙醇和乙酸均可与钠反应放出氢气 | |
| B. | 乙烯和苯均能使溴水褪色,且原理相同 | |
| C. | 等物质的量的正丁烷和异丁烷,含有非极性键的数目相同 | |
| D. | 甲烷在光照条件下与Cl2发生取代反应,共得到5种产物 |
14.化学在生产和生活中有着重要的应用.下列说法正确的是( )
| A. | 漂白粉和明矾常用于水处理,这两者净水原理相同 | |
| B. | “地沟油”经过加工处理可用来制肥皂,可实现厨余废物合理利用 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 高炉炼铁的常用FeS2作为炼铁的原料 |
11.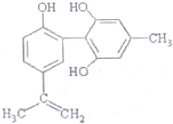 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO,溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质的分子式为C14H28O3 | |
| D. | lmol该物质分别与浓溴水和H2反应时,最多消耗Br3和H2分别为4mol和7mol |
18.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是( )
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素最高价氧化物对应水化物的酸性一定强于Y | |
| C. | X与Y元素形成的两种常见化合物分别溶于水后溶液PH<7 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
2.下列反应的离子方程式正确的是( )
| A. | 氧化铝和氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| B. | 硫酸溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氯化铝中加入过量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
3.下列表述正确的是( )
| A. | 羟基的电子式: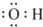 | B. | 醛基的结构简式:-COH | ||
| C. | 聚丙烯的结构简式: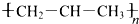 | D. | 1-丁烯的键线式: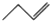 |