题目内容
15.下列关于氯化铵溶液的说法正确的是( )| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
分析 氯化铵水解呈酸性,溶液中存在NH4++H2O?NH3•H2O+H+,水解反应吸热,升高温度促进水解,结合离子浓度对平衡移动的影响解答该题.
解答 解:A.水解反应吸热,升高温度促进水解,故A正确;
B.如加入碱,则平衡正向移动,但pH增大,故B错误;
C.向溶液中加入氯化钠固体,平衡不发生移动,故C错误;
D.向溶液中加入氯化铵固体,水解平衡向右移动,但水解程度减小,故D错误.
故选A.
点评 本题考查了盐类水解,为高频考点,侧重于学生的分析能力的考查,注意把握影响盐类水解的因素,难度不大.

练习册系列答案
相关题目
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
6.下列有关电池的说法不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅蓄电池放电时,负极的质量逐渐减小 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
3.下列表述正确的是( )
| A. | 羟基的电子式: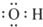 | B. | 醛基的结构简式:-COH | ||
| C. | 聚丙烯的结构简式: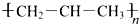 | D. | 1-丁烯的键线式: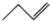 |
10. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
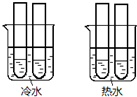
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
20.能正确表示下列反应的离子方程式是( )
| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
7.主族元素X、Y、Z的常见离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法不正确的是( )
| A. | b一定小于c | B. | 单质的氧化性Z>Y | ||
| C. | Y2-的还原性大于Z- | D. | X、Y可处于同周期或X在Y的下周期 |
5.有关二氧化硫的叙述正确的是( )
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
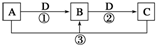 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).