题目内容
10.设阿伏加德罗常数的值为NA,下列说法正确的是( )| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
分析 A.1mol硫酸钾中含有1mol硫酸根离子,带有2mol负电荷;
B.一氧化氮和氮气的摩尔质量都是28g/mol,分子数为NA的CO、氮气混合气体的物质的量为1mol;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氢气的物质的量;
D.50mL 8mol/L浓盐酸与足量的MnO2加热反应,随反应进行浓盐酸浓度减小,变稀后不与二氧化锰反应生成氯气.
解答 解:A.1 mol硫酸钾中阴离子硫酸根离子的物质的量为1mol,带有2mol负电荷,所带电荷数为2NA,故A错误;
B.分子数为NA的CO、氮气混合气体的物质的量为1mol,标况下1mol混合气体的体积约为22.4L,二者的摩尔质量都是28g/mol,则1mol该混合气体的质量为28g,故B正确;
C.不是标况下,不能使用标况下的气体摩尔体积计算3.36L氢气的物质的量,故C错误;
D.50mL 8mol/L浓盐酸与足量的MnO2加热反应,随反应进行浓盐酸浓度减小,变稀后不与二氧化锰反应生成氯气,生成Cl2分子数小于0.1NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,明确标况下气体摩尔体积的使用条件,C为易错点,需要注意题中没有告诉在标况下.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列冶炼金属的原理及方程式不正确的是( )
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
11.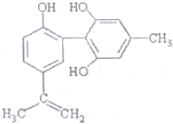 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO,溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质的分子式为C14H28O3 | |
| D. | lmol该物质分别与浓溴水和H2反应时,最多消耗Br3和H2分别为4mol和7mol |
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
2.下列反应的离子方程式正确的是( )
| A. | 氧化铝和氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| B. | 硫酸溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氯化铝中加入过量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
19.氢氧燃料电池已用于航天飞机.以20%NaOH溶液为电解质溶液的这种电池在使用时的电极反应如下:
2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-据此判断,下列说法中正确的是( )
2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-据此判断,下列说法中正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 燃料电池属二次电池 | |
| C. | 燃料电池的能量转化率常达100% | |
| D. | 供电时产生无污染的水,属于环境友好电池 |
20.能正确表示下列反应的离子方程式是( )
| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |